Лекция № 19
· Реакции SEAr в замещенных бензолах. Факторы, влияющие на скорость реакции и соотношение образующихся изомеров. Правила ориентации. Влияние природы заместителя на устойчивость s-комплексов и направление SE реакций. Активирующие и дезактивирующие заместители. Орто -, пара - и мета -ориентанты. Согласованная и несогласованная ориентация.
· Реакции гомологов бензола с участием боковой цепи: галогенирование, окисление. Окисление алкилбензолов и конденсированных ароматических углеводородов до карбоновых кислот.
· Реакции присоединения (галогенирование, гидрирование, озонолиз), окисление бензола.
Если в бензольном кольце есть хотя бы один заместитель, реакции SEAr заметно усложняются. Во-первых, имеющийся заместитель может активировать или дезактивировать кольцо, во-вторых, дизамещенные бензолы могут существовать в виде трех изомеров. Таким образом, при введении второй группы в бензольный цикл надо ответить на два вопроса:
· как идет реакция (легче или труднее в сравнении с незамещенным бензолом);
· куда идет реакция (в орто -, мета - или пара -положение).
Поскольку определяющая стадия реакции – переходное состояние образования s-комплекса, строение которого не может быть определено, рассмотрим влияние донорных и акцепторных заместителей на стабильность самого s-комплекса. В соответствии с постулатом Хэммонда все структурные факторы, стабилизирующие s-комплекс, будут понижать энергию переходного состояния и, следовательно, облегчать реакцию. Соответственно структурные факторы, дестабилизирующие s-комплекс, будут затруднять реакцию. Любой уже связанный с ароматическим циклом заместитель может быть либо электронодонорным, либо электроноакцепторным. Рассмотрим, как донорные и акцепторные свойства заместителя (независимо от того, за счет индуктивного I или мезомерного эффекта M эти свойства проявляются) будут влиять на устойчивость s-комплекса.
Электронодонорные заместители, отдавая часть своей электронной плотности, увеличивают последнюю в цикле, стабилизируя интермедиат. Следовательно, наличие в цикле доноров облегчает протекание реакции SEAr. Донорные группировки (-OH, -NH2, -NHAlk, -NAlk2, -OR, -NHC(=O)R, Alk, Ar – расположены по степени убывания донорных свойств) называют активирующими.

Электроноакцепторные заместители уменьшают электронную плотность s-комплекса, дестабилизируя интермедиат. Таким образом, наличие в цикле акцепторов затрудняет протекание реакции SEAr. Акцепторные группы (-CN, -COOH, -COOR, -CHO, -COR, NO2, -N+R3, SO3H, CCl3, галогены и многие другие) называют дезактивирующими. Следует отметить, что дезактивирующие группы невозможно однозначно расположить в ряд по их дезактивирующему действию.

Таким образом, все донорные заместители активируют кольцо в реакциях ароматического электрофильного замещения (облегчают реакцию), все акцепторные – дезактивируют (затрудняют реакцию). Термины «облегчают» и «затрудняют» используют при сравнении однотипных реакций либо по отношению к незамещенному бензолу, либо в однотипных рядах производных.
Для понимания ориентирующих свойств заместителей используется тот же подход, что и для определения активирующих и дезактивирующих. При анализе строения интермедиата нужно найти структурные факторы, которые его стабилизируют или дестабилизируют. Интуитивно понятно, что донорные заместители будут обладать одними, акцепторные – другими ориентирующими свойствами.
Один из самых простых примеров – свойства алкильных групп, обладающих положительным индуктивным (+I) эффектом. Индуктивный эффект проявляется тем сильнее, чем меньше расстояние. При замещении в орто - или пара -положения среди соответствующих граничных структур есть по одной особенно энергетически выгодной. В них донорная группировка непосредственно связана с углеродом, несущим положительный заряд. В случае замещения в мета -положение такой энергетически выгодной структуры нет. Группировки, обладающие +I эффектом, - орто - и пара -ориентанты.
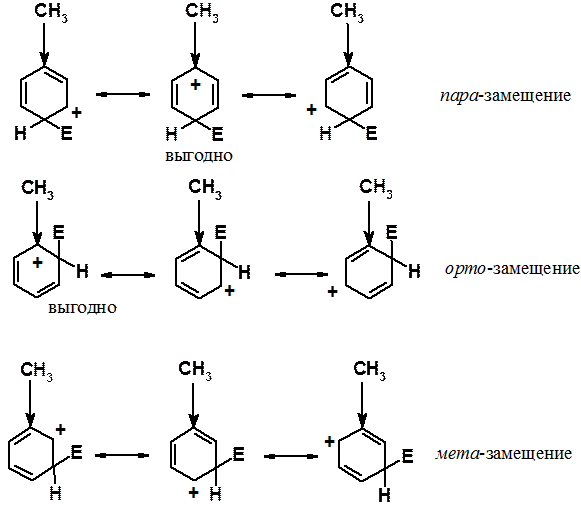
Рассмотрим свойства группировок, обладающих +М эффектом (способных отдавать электронную плотность за счет эффекта сопряжения) на примере амино-группы.
При атаке в орто - и пара -положения соответствующие s-комплексы могут быть изображены с помощью четырех граничных структур. Одна из них энергетически очень выгодна, поскольку она представляет собой не карбониевый, а аммониевый катион. При реакции в мета -положение структуру такого типа написать не удается. Аммониевые катионы очень устойчивы, достаточно вспомнить о существовании большого числа неорганических солей (например, NH4Cl), стабильных при комнатной температуре. Кроме того, при оценке стабильности ионов (молекул и свободных радикалов) с использованием граничных структур применяется простое правило: чем больше граничных структур можно написать, тем стабильнее ион (молекула, свободный радикал). Отчетливо видно, что при вхождении электрофила в орто - и пара -положения соответствующие s-комплексы показаны с помощью четырех структур, а при реакции в мета -положение граничных структур только три.
Таким образом, донорные заместители активируют все положения кольца к реакции ароматического электрофильного замещения, но орто - и пара -положения активированы в большей степени, чем мета -.
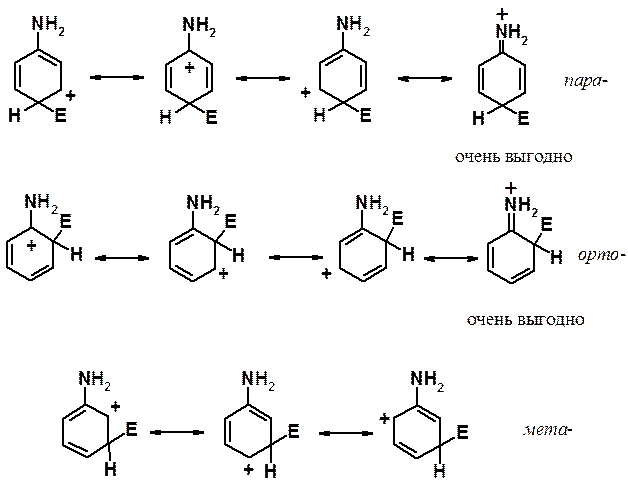
Акцепторные заместители (дезактивирующие) направляют входящий заместитель в мета -положение кольца. Доказательство аналогично изложенному выше. При протекании реакции в орто - или пара -положения есть по одной очень богатой энергией граничной структуре. В них акцептор непосредственно связан с атомом углерода, несущим положительный заряд. Как было указано, индуктивный эффект проявляется на небольших расстояниях. В этих граничных структурах акцептор сильнее всего уменьшает электронную плотность на атоме углерода, т.е. еще больше увеличивает на нем положительный заряд. Энергия орто - и пара -s-комплексов выше, чем у интермедиата реакции, протекающей в мета -положение. В последнем случае нет особенно невыгодных по энергии структур.
Акцепторные (дезактивирующие) заместители дезактивируют все положения бензольного цикла в реакциях ароматического электрофильного замещения, но мета -положение дезактивировано в меньшей степени, чем орто - и пара -. Следовательно, акцепторы являются мета -ориентантами.
В некоторых изданиях орто -, пара -ориентанты называют ориентантами I рода, мета -ориентанты – ориентантами II рода.

Суммируя вышеизложенное
· активирующие заместители – орто - и пара -ориентанты;
· дезактивирующие заместители – мета -ориентанты.
Все изложенное имеет одно исключение:
 2014-02-02
2014-02-02 8846
8846
