КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ФЕРМЕНТОВ
Классификация ферментов основана на природе катализируемых реакций.
Существуют 6 основных классов ферментов.
| № п/п | Класс | Тип катализируемой реакции |
| 1. 2. 3. 4. 5. 6. | Оксидоредуктазы Трансферазы Гидролазы Лиазы Изомеразы Лигазы (синтетазы) | Перенос электронов (окислительно-восстановительные реакции) Реакции с переносом групп (амино-, глико, ацил-) с одной молекулы на другую Реакции гидролиза (перенос функциональных групп на молекулу Н2О) Присоединение групп по двойным связям и обратные реакции Реакции изомеризации, т.е. перенос групп внутри молекулы с образованием изомерных форм Образование С-С-, С-S-, C-O-, C-N- связей за счет реакций конденсации, сопряженных с распадом АТФ |
По классификации ферментов (КФ- русскоязычная, ЕС-англоязычная) каждый фермент (энзим) имеет свой определенный номер, состоящий из четырех групп цифр, разделенных точками. Первая цифра обозначает отнесение фермента к классу (одному из шести):
1. Оксидоредуктазы
2. Трансферазы
3. Гидролазы
4. Лиазы (Синтазы)
5. Изомеразы
6. Лигазы (Синтетазы)
Внутри каждого класса происходит разделение на подклассы, например, внутри первого класса различают:
EC 1.1 Действующие на CH-OH группы донора
EC 1.2 Действующие на альдегидные или оксо- группы донора
EC 1.3 Действующие на CH-СH группы донора
EC 1.4 Действующие на CH-NH2 группы донора
EC 1.5 Действующие на CH-NH группы донора
EC 1.6 Действующие на NADH или NADPH
Внутри каждого подкласса происходит разделение на подподклассы:
EC 1.1.1 Акцептор NAD или NADP
EC 1.1.2 Акцептор- цитохром
EC 1.1.3 Акцептор- кислород
EC 1.1.4 Акцептор- сульфид
EC 1.1.5 Акцептор- хинон или подобная группировка
EC 1.1.99 Другой акцептор
Последнее число - номер конкретного энзима:
EC 1.1.1. 1 alcohol dehydrogenase
EC 1.1.1. 2 alcohol dehydrogenase (NADP+)
EC 1.1.1. 3 homoserine dehydrogenase
EC 1.1.1. 4 (R,R)-butanediol dehydrogenase
EC 1.1.1. 5 acetoin dehydrogenase
Разделение ферментов на классы строгое и не допускает произвольного изменения номеров.
Ферменты, кроме того, имеют названия, которые разделяются на рабочие и систематические. Рабочие названия образуются из объединения названия субстрата, типа реакции и окончания "-аза". Например: ЛАКТАТ + ДЕГИДРОГЕНизация + АЗА = ЛАКТАТДЕГИДРОГЕНАЗА. Систематическое название фермента формируется следующим образом: (название субстратов (через дробь), название типа химического превращения + аза). Та же л актатдегидрогеназа будет иметь систематическое название " L-лактат:NAD+ оксидоредуктаза ".
Рассмотрим подробнее классификацию ферментов.
КЛАССЫ ФЕРМЕНТОВ:
1. ОКСИДОРЕДУКТАЗЫ - катализируют реакции окисления-восстановления:
Лактатдегидрогеназа (LDH, EC 1.1.1.27) катализирует превращение молочной кислоты (лактат) в пировиноградную (пируват):
СН3СН(ОН)СООН + NAD+ à CH3COCООH + NAD H + H +
2. ТРАНСФЕРАЗЫ - (РЕАКЦИИ ПЕРЕНОСА ГРУППИРОВОК С ОДНОГО СОЕДИНЕНИЯ НА ДРУГОЕ):
(холинацетилтрансфераза, ЕС 2.3.1.6, систематическое название: ацетил-КоА: холин О-ацетилтрансфераза)
СH3CO -S-KoA + HO-СН2-СН2-N+(CН3)3 à КоА-SH + СН3СОO-СН2-СН2-N+(CН3)3
3. ГИДРОЛАЗЫ (фосфатазы, эстеразы, фосфолипазы) (разрыв связей с присоединением воды):
а) Дипептидаза расщепляет дипептид на две аминокислоты при участии воды:
H2N-CH(R)-CO - NH-CH(R')-COOH + H2O à H2N-CH(R)-COOH + NH2-CH(R')-COOH
б) Холинэстераза (ЕС 3.1.1.7, ацетилхолин ацетилгидролаза) катализирует реакцию гидролиза сложного эфира холина и уксусной кислоты (ацетилхолина):
CH3COO-CH2-CH2-N+(CH3)3 + H2O à CH3COOH + HO-CH2-CH2-N+(CH3)3
4. ЛИАЗЫ (альдолазы, гидратазы-дегидратазы, синтазы, декарбоксилазы) (катализ реакций разрыва связей в субстрате без присоединения воды или окисления):
пируватдекарбоксилаза (ЕС 4.1.1.1, 2-кетокислоты карбокси-лиаза) катализирует расщепление пирувата до уксусного альдегида с отщеплением СО2:
CH3COCООH à CH3COH + СО2
карбоксилаза (плюс СО2)
дегидратаза (минус Н2О)
Цитрат-дегидратаза (ЕС 4.2.1.4, цитрат гидро-лиаза) катализирует отщепление-присоединение воды от лимонной кислоты с образованием аконитата и изоцитрата:
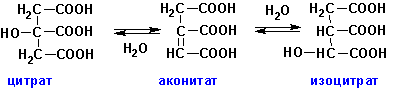
Фермент катализирует как прямые, так и обратные реакции.
синтаза (соединение двух мелких в один крупный)
Цитрат-синтаза (бывший ЕС 4.1.3.7) синтезирует лимонную кислоту из оксалоацетата (щавелевоуксусной кислоты, ЩУК) и молекулы Ацетил-КоА:
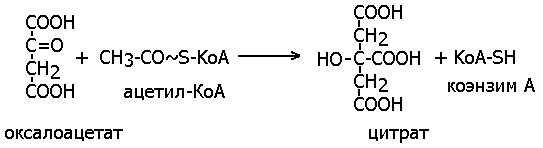
Приведенная выше реакция схожа с реакциями переноса групп, катализируемых трансферазами (энзимы 2-го класса), поскольку происходит перенос ацетильной группы с Ацетил-КоА на оксалоацетат, поэтому в настоящее время цитрат-синтаза отнесена к энзимам этого класса, имеет номер ЕС 2.3.3.1 и систематическое название ацетил-КоА: оксалоацетат С-ацетилтрансфераза (acetyl-CoA:oxaloacetate C-acetyltransferase [thioester-hydrolysing, (pro-S)-carboxymethyl forming]).
5. ИЗОМЕРАЗЫ (рацемазы, эпимеразы, мутазы) (внутримолекулярные перестройки).
Глюкозо-6-фосфат-изомераза (ЕС 5.3.1.9, D-глюкозо-6-фосфат кето-изомераза), например, превращает глюкозо-6-фосфат во фруктозо-6-фосфат и наоборот:
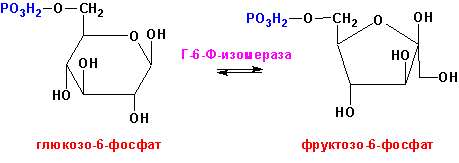
6. ЛИГАЗЫ (синтетазы, соединяют 2 части с использованием энергии АТФ). Реакции ферментов этого класса, как правило, необратимы.
Так, аспартат-синтетаза ( ЕС 6.3.1.1, L-аспартат: аммиак-лигаза (АМФ-образующая) при участии молекулы АТФ синтезирует аспарагин из аспарагиновой кислоты и аммиака:
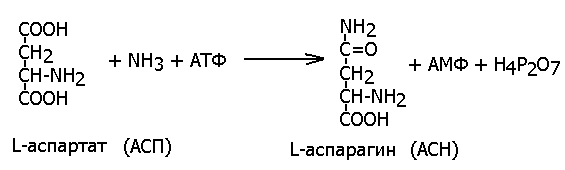
К подклассу 6.1 относят ферменты, катализирующие образование связей С-О (в том числе Аминоацил-т-РНК-синтетазы), к подклассу 6.2- образование связей C-S, 6.3- связей C-N, 6.4- связей С-С и 6.5- связей Р-О.
Например, к подклассу 6.4 относится фермент пируваткарбоксилаза (ЕС 6.4.1.1, пируват: СО2-лигаза (АДФ-образующая), при участии которой происходит превращение пирувата в оксалоацетат:
СО2 + СН3-СО-СООН + АТФ à HOOC - CH2-CO-COOH + АДФ + Н3РО4
Ферменты обнаруживают все свойства белков. Все известные в настоящее время ферменты представляют собой глобулярные белки. Молекулярные массы ферментов лежат в пределах от 12 тыс. до 1 млн. Для ферментативной активности белков важное значение имеет сохранение их первичной, вторичной и третичной структур.
Некоторые ферменты состоят только из полипептидных цепей и не содержат других химических групп. Это однокомпонентные ферменты (рибонуклеаза из поджелудочной железы). Однако для каталитической активности многих ферментов необходим еще и дополнительный химический компонент – кофактор. Двукомпонентные ферменты состоят из белка и кофактора. Роль кофакторов могут играть неорганические вещества, например ионы Fe2+, Mn2+, Zn2+ или сложные органические вещества, которые в этом случае носят название коферментов. Кофермент, прочно связанный с ферментным белком, называется простетической группой фермента. Во многих случаях кофермент связан с ферментным белком слабо. Весь каталитически активный фермент вместе с коферментом или ионом металла носит название х олофермента:
Апофермент (неактивный белок)
+ } холофермент
кофактор (активный фермент)
Коферменты и ионы металлов термостабильны, тогда как белковая часть фермента, называемая апоферментом, денатурирует при нагревании (т.е. полипептидные цепи разворачиваются). Коферменты служат промежуточными переносчиками атомов или функциональных групп (атомов Н, аминогрупп – NH2, метильных групп – CH3, ацильных групп) от одного субстрата к другому.

ФУНКЦИИ КОФЕРМЕНТОВ (КФ) И ПРОСТЕТИЧЕСКИХ ГРУПП (ПГ)
1. Участие в акте катализа
2. Осуществление контакта между энзимом и субстратом
3. Стабилизация апофермента
Апофермент, в свою очередь, усиливает каталитическую активность небелковой части (КФ и ПГ). Например, одна и та же NAD+ является КФ многих дегидрогеназ, отличие- в апоферментной части.
АКТИВНЫЙ ЦЕНТР - часть молекулы Ф. где происходит связывание и превращение субстрата. У Ф., имеющих четвертичную структуру, число АЦ может быть равно числу субъединиц.
Сам АЦ функционально неоднороден и имеет КАТАЛИТИЧЕСКУЮ ЗОНУ и СВЯЗЫВАЮЩУЮ З. Связывание субстрата- многоточечное.
СПЕЦИФИЧНОСТЬ Ф. бывает ОТНОСИТЕЛЬНАЯ (катализ превращений небольшой группы близких по свойствам СУБСТРАТОВ) и АБСОЛЮТНАЯ- катализ превращения только одного вещества.
СТРОЕНИЕ И ФУНКЦИИ ОТДЕЛЬНЫХ КФ И ПГ.
1. нуклеотидного типа строения
2. витамины и их производные
3. металлы и металлсодержащие КФ и ПГ
4. другие
НИКОТИНАМИДНЫЕ КОФЕРМЕНТЫ NAD+ и NADP+
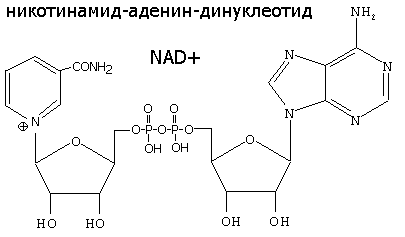
NAD+, NADP+- содержащие дегидрогеназы катализируют перенос гидрид-иона (Н-) от субстрата к никотинамидной части кофермента:
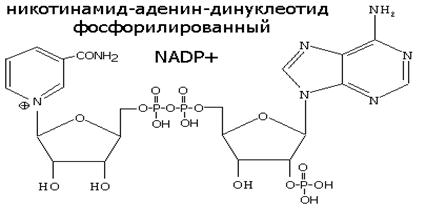
Восстановленная при этом часть кофермента отличается от окисленной только по производному никотиновой кислоты:
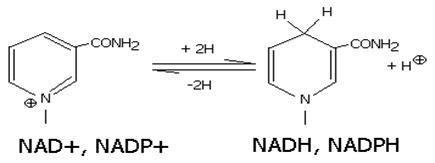
Восстановленные формы NADH и NADPH отсоединяются от апофермента и отделяются от дегидрогеназы. Затем они переносят гидрид ион на другую молекулу фермента (чаще всего- FMN, FAD-зависимого).
Катализируют обратимые реакции окисления спиртов, оксикислот, аминов и др. Хорошо изучены LDH- лактатдегидрогеназа, MDH- малатдегидрогеназа, ADH- алкогольдегидрогеназа. Для дегидрогеназ характерно наличие четвертичной структуры (ADH, MDH- димеры, LDH-тетрамер).
Спектральные различия- NAD+, NADP+- 260 nm, NADH, NADPH- 260, 340 nm).
Окисленные формы флавиновых простетических групп выглядят следующим образом:
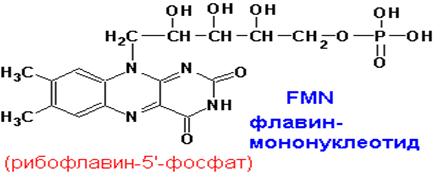
Изоаллоксазиновое кольцо флавиновых ПГ имеет следующие спектральные свойства: окисленная форма- 280, 350-380, 450 нм, восстановленная- 280, 350-380 (с меньшими e).
FMN и FAD катализируют переходы: спирты-альдегиды, амины-имины, насыщ. карбонильные-a,b- ненасыщ. карбонильные, NADH, NADPH-NAD+, NADP+.
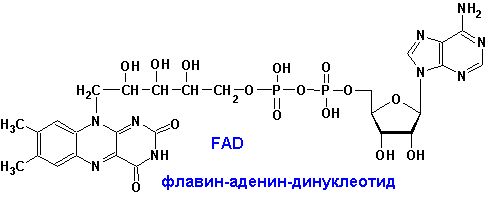
FMN, FAD- более сильные окислители. Сами передают гидрид ион непосредственно на кислород:
FADH2, FMNH2 + O2 à FAD, FMN + H2O2
НУКЛЕОЗИДТРИФОСФАТЫ И НУКЛЕОЗИДДИФОСФАТ-САХАРА (НДФС)
АТФ, УТФ, ГТФ, ЦТФ- коферменты фосфотрансфераз (перенос ФОСФАТА, ПИРОФОСФАТА, АМФ ИЛИ АДЕНОЗИНОВОЙ ЧАСТИ).
Перенос нуклеозида аденозин на метионин с молеклы АТФ выглядит следующим образом:
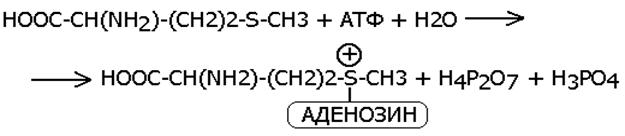
НУКЛЕОЗИДДИФОСФАТ-САХАРА (НДФС)
УРИДИНДИФОСФАТ-ГЛЮКОЗА (УДФ-ГЛЮКОЗА) кофермент переноса остатка углевода:
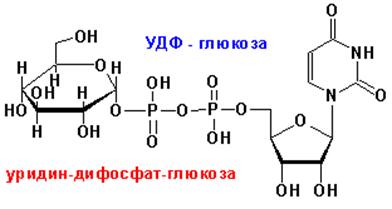
УДФ-ГЛЮКОЗА + ФРУКТОЗА à УДФ + САХАРОЗА
КОФЕРМЕНТ АЦЕТИЛИРОВАНИЯ (КОЭНЗИМ А, или просто КоА)
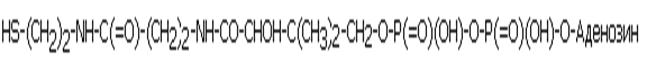
Участвует в реакциях активации и переноса ацетильных и ацильных групп (присоединяется к S- в составе КоА, с образованием ацетил-КоА или ацил-КоА.
 2014-01-31
2014-01-31 1026
1026
