ГИДРОЛИЗ
ОСАДКООБРАЗОВАНИЕ
ХИМИЧЕСКОЕ САМООЧИЩЕНИЕ
Процессы перераспределения ЗВ в водной среде могут сопровождаться их химической трансформацией. При этом трансформация может осуществляться как в растворенном, так и в сорбированном состояниях. Рассмотрим некоторые процессы трансформации ЗВ в природных водах.
Многие загрязняющие вещества являются слабыми кислотами или основаниями и участвуют в кислотно-основных превращениях. Соли, образованные слабыми основаниями или слабыми кислотами, подвергаются гидролизу. Соли, образованные слабыми основаниями,. гидролизуются по катиону, соли, образованные слабыми кислотами, – по аниону. Гидролизу подвергаются катионы ТМ, Fe3+, Al3+:
Fe3+ + HOH ↔ FeOH2+ + H+
Al3+ + HOH ↔ AlOH2+ + H+
Cu2+ + HOH ↔ CuOH+ + H+
Pb2+ + HOH ↔ PbOH+ + H+.
Эти процессы вызывают подкисление среды.
Гидролизуются анионы слабых кислот:
CO32- + HOH ↔ HCO3- + OH-
SiO32- + HOH ↔ HSiO3- + OH-
PO43- + HOH ↔ HPO42- + OH-
S2- + HOH ↔ HS- + OH-,
что способствует подщелачиванию среды.
Одновременное наличие гидролизующихся катионов и анионов вызывает в некоторых случаях полный необратимый гидролиз, который может привести к образованию осадков малорастворимых гидроксидов Fe(OH)3, Al(OH)3 и др.
Среди органических соединений гидролизу подвергаются эфиры и амиды карбоновых кислот и различных фосфорсодержащих кислот. При этом вода участвует в реакции не только как растворитель, но и как реагент:
R1–COO–R2 + HOH ↔ R1–COOH + R2OH
R1–COO–NH2 + HOH ↔ R1–COOH + NH3
R1―O―P=O + HOH ↔ H 3PO4 + R1OH + R2OH + R3OH
R2―O ⁄ |
R3―O
В качестве примера можно упомянуть дихлофос (о,о-диэтил-2,2-дихлорвинилфосфат).
C2H5―O―P=O + 2HOH ↔ H―O―P=O + 2C2H5OH
C2H5―O ⁄ | H―O ⁄ |
Cl2C=CH―O Cl2C=CH―O
Гидролизуются и различные галогенорганические соединения:
R–Cl + HOH ↔ R–OH + HCl
R–C–Cl + 2HOH ↔ R–C–OH + 2HCl ↔ R–C=O + H2O + 2HCl
\ Cl \ OH \ H
R–C–Cl + 3HOH ↔ R–C–OH + 3HCl ↔ R–C=O + 2H2O + 3HCl
| \ Cl | \ OH \ OH
Cl OH
Эти гидролитические процессы совершаются в другой временной шкале. Реакции гидролиза могут осуществляться как без катализатора, так и с участием в качестве катализаторов растворенных в природных водах кислот и оснований. Соответственно константа скорости гидролиза может быть представлена в виде:
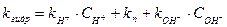 , где (185)
, где (185)

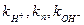 - константы скорости кислотного гидролиза, гидролиза в нейтральной среде и щелочного гидролиза.
- константы скорости кислотного гидролиза, гидролиза в нейтральной среде и щелочного гидролиза.
При этом можно считать гидролиз реакцией псевдопервого порядка, так как ЗВ присутствую в природных водах в следовых количествах. Концентрация воды по сравнению с их концентрациями много больше и практически считается неизменной.
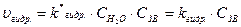 .
.
Константы скорости гидролиза некоторых ЗВ приведены в таблице 15.
Таблица 15 – Константы скорости гидролиза некоторых органических веществ при 298К, pH = 7
| Вещество | Продукты гидролиза | Константы гидролиза | τ½, полу- период гидролиза | ||
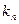 ,с-1 ,с-1
| 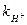 ,
л·моль-1· с-1 ,
л·моль-1· с-1
| 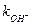 ,
л ·моль-1·с-1 ,
л ·моль-1·с-1
| |||
| Метилхлорацетат | Хлоруксусная кислота, метанол | 2,1 ·10-7 | 8,5 ·10-5 | 0,57 сут. | |
| Бромметан | Метанол, бромоводород | 4,7 · 10-7 | ― | 1,4 ·10-4 | 17 сут. |
| Этилацетат | Уксусная кислота, этанол | 0,15 | 1,1 · 10-4 | 0,11 | ~5с |
| Трихлорметан | Муравьиная кислота, хлороводород | ― | ― | 6,9 ·10-5 | ~3180 лет |
 2014-01-31
2014-01-31 842
842







