В окислении ЗВ участвуют свободные радикалы и другие реакционноспособные частицы.
В качестве окислителя участвуют ионы металлов в окисленной форме;
ОКИСЛЕНИЕ
Процессы окисления ЗВ в природных водах могут быть двух типов:
Процессы с участием ионов металлов наиболее вероятны для загрязнителей, обладающих выраженными лигандными и восстановительными свойствами. Среди ионов переходных металлов окислительные свойства в природных водах наиболее ярко проявляют простые и комплексные ионы меди (II), а также коллоидные частицы гидроксида железа (III).
Радикалы в общем случае взаимодействуют со всеми растворенными в воде органическими и неорганическими веществами. Поэтомупроцессы второго типа играют более существенную роль в самоочищении природных вод. Рассмотрим их более подробно.
Известно несколько путей образования свободных радикалов в природных водах:
– каталитическое инициирование;
– растворение активных газов из атмосферы;
– радиационно-химическое инициирование;
– биологическая эмиссия;
– кавитационные эффекты;
– фотохимическое инициирование.
Каталитическое инициирование. Как правило, в природных водах каталитическое инициирование свободных радикалов связано с одноэлектронным восстановлением O2, H2O2. В природных водах инициаторами радикалов являются главным образом ионы меди Cu+. Инициаторами радикалов могут быть ионы Fe2+ и хелатные комплексы железа (II), но для их образования необходимо восстановление гидроксида железа (III), т.е. необходимо присутствие в водной среде веществ восстановительной природы.
Каталитическое инициирование может протекать по циклическому механизму. При этом окислительной частицей является ион металла в окисленном состоянии. Роль O2 (H2O2) сводится к регенерации окисленной формы металла при окислении восстановленной формы, образующейся в процессе окисления субстрата-донора DH2:
2Cu2+ + DH2 → 2Cu+ + D + 2H+
Cu+ + O2 ↔ (CuO2)+ → Cu2+ + O2-
Cu+ + H2O2 ↔ (CuH2O2)+ → CuOH+ + •OH
или
2Fe3+ + DH2 → 2Fe2+ + D + 2H+
Fe2+ + H2O2 ↔ (FeH2O2)2+ → FeOH2+ + •OH.
Каталитическое инициирование может протекать и по радикально-цепному механизму. Классический пример радикально-цепного процесса – каталитическое разложение H2O2 в кислой среде:
Инициирование цепи:
Fe3+ + H2O2 → Fe2+ + HO2• + H+
2Fe3+ + H2O2 → 2Fe2+ + O2 + 2H+.
Продолжение цепи:
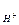
Fe2+ + H2O2 → Fe3+ + 2 •OH
•OH + H2O2 → HO2• + H2O
HO2• + Fe3+ → Fe2+ + O2.
Обрыв цепи: 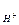
Fe2+ + HO2• → Fe3+ + H2O2 и др.
В случае ионов меди окислительно-восстановительный потенциал пары Сu2+/Cu+ слишком низкий (0,153 В), чтобы ион Cu2+ мог окислить H2O2 в кислой среде. В то же время при наличии внешних источников инициирования (например, примесь ионов Fe3+, УФ-излучение) реализуется эффективный радикально-цепной процесс, протекающий по схеме приведенной выше.
Расчеты показывают, что скорость каталитического инициирования радикалов в природных водах может достигать порядка 10-10 моль · л-1·с-1.
Растворение активных газов из атмосферы. Образование радикалов в водной среде за счет растворения активных газов из атмосферы может быть связано как с растворением активных радикалов •OH, HO2•, так и менее реакционноспособных NO2, CH3O2•. Очевидно, чем более реакционноспособны радикалы, тем меньше глубина проникновения их в толщу воды. Так, радикалы •OH, HO2• будут реагировать лишь в поверхностном слое. По имеющимся оценкам поток радикальных частиц из атмосферы крайне незначителен. Гораздо более важную роль играет растворение озона. Содержание О3 у земной поверхности невелико. Тем не менее средний поток О3 из атмосферы в воду составляет 1010 молекул · см-2 · см-1, что на 3-5 порядков больше, чем поток HO2•. Стационарная концентрация озона в приповерхностных слоях воды достигает 10-8моль· л-1.
В воде озон легко превращается в кислород, причем процесс это протекает через образование промежуточных свободных радикалов •OH, O2- и совершается по цепному механизму, включающему 12 элементарных стадий. Суммарный процесс записывается в виде:
2О3 → 3О2.
При наличии в водной среде веществ-восстановителей более вероятно взаимодействие растворенного озона не с •OH, HO2•, а с донорами электрона:
O3 + DH- → HO3 + D-•
O3 + D-• → O3- + D•.
Фактически в стационарных условиях в естественной водной среде скорость образования радикалов при растворении озона будет определяться скоростью его поступления в водную среду. При глубине реакционной зоны 10 см эта скорость тем выше, чем выше содержание О3 в атмосфере.
Из других газов в инициировании радикалов может принимать участие NO2 способный отрывать электрон от донора, в частности от H2O2:
NO2 + DH- → HNO2 + D-•
NO2 + HO2- → NO2- + HO2•.
В обычных условиях (без принудительного увеличения потока O3, NO2 в водную среду) скорость инициирования радикалов за счет растворения активных газов относительно мала.
Радиационное инициирование в отсутствие радиационного загрязнения водной среды осуществляется под действием естественного радиоактивного фона (космических лучей, достигающих поверхности Земли, а также при распаде природных радиоактивных изотопов, в частности 40К). Скорость образования радикалов под действием космического излучения составляет всего 3 · 10 -18моль · л-1 · с-1. За счет распада 40К она еще меньше – 3· 10 -19моль · л-1 · с-1. Это пренебрежимо малые величины.
В то же время при радиационном загрязнении скорость инициирования свободных радикалов резко возрастает. Например, на Киевском водохранилище после аварии на Чернобыльской АЭС в июне 1986г. скорость инициирования достигала 10 -9моль · л-1 · с-1.
Воздействие радиационного излучения направлено в первую очередь на воду и приводит к образованию целого набора активных и стабильных промежуточных частиц:
α,β,γ
H2O → •OH, H•, H2O2, H2, e-.
В аэробной водной среде частицы H•, e- взаимодействуют с О2 с образованием радикалов HO2•, O2-. Фактически при радиолизе аэрированной воды в нейтральной среде происходит генерация •OH и O2-:
α,β,γ
H2O → •OH, O2-.
О2
Скорость инициирования радикалов определяется поглощенной дозой и радиационным выходом – числом частиц на 100 эВ поглощенной энергии. Радиационный выход для радикалов •OH и O2- равен 3.
Биологическая эмиссия свободных радикалов – малоизученное явление. Известны примеры образования радикала O2- некоторыми видами организмов (макрофагами). Почвенные грибы выделяют одновременно H2O2 и катализатор, способствующий образованию •OH. Такие грибы участвуют в разрушении столь химически инертных соединений как лигнин, ДДТ. Некоторые почвенные бактерии выделяют радикал NO в ходе окисления NH3.
В природной воде образование радикалов за счет биологических процессов происходит опосредованно. Например, микроводоросли стимулируют радикальные процессы в природной воде. Водоросли продуцируют во внешнюю среду вещества-восстановители, которые в присутствии H2O2 способствуют образованию свободных гидроксильных радикалов, взаимодействуя с ионами меди (как основными природными катализаторами окислительно-восстановительных процессов).
Кавитационные эффекты могут играть значительную роль, но количественно вопрос недостаточно изучен. В толще природных вод присутствуют своего рода «облака» из микропузырьков газовой фазы. Размер пузырьков 1-10 мкм, поверхность их покрыта тончайшей пленкой поверхностно-активных веществ. Вода, которая была бы полностью лишена таких пузырьков, в природе практически не встречается. В обычных условиях доля свободного газа в природных водах по сравнению с растворенным газом составляет всего 10-9. однако при изменении условий (температура, скорость движения, физические воздействия) эта доля может достигать 10-2. При этом поверхность раздела газ – вода в водной среде за счет пузырьков газа может увеличиваться на много порядков.
Процессы «схлопывания» пузырьков (кавитация) характеризуются необычайно высокими энергетическими характеристиками (из-за большой поверхностной свободной энергии). В момент «схлопывания» возникают огромнейшие импульсные давления, электрические разряды, происходит ионизация частиц и разрыв химических связей). Кратковременные перепады давлений достигают сотен атмосфер. Возникают большие градиенты электрического поля. Движение природной воды, насыщенной микропузырьками. В электромагнитном поле приводит к интенсификации процессов «схлопывания» и разрыва пузырьков, сопровождающихся образованием свободных радикалов и других активных частиц. Наибольшие нарушения физико-химических свойств водных систем происходят в условиях турбулентного режима течения и наличия неоднородного магнитного поля. динамичный нестационарный характер природной водной среды приводит к непрерывной генерации электрических и магнитных полей, постоянному перераспределению объемных зарядов масс воды. все это определяет возможность участия кавитационных эффектов в инициировании свободных радикалов в природных водах.
Образование свободных радикалов •OH в результате кавитационных эффектов доказано экспериментально. Взаимодействие гидроксильных радикалов с растворенными в воде органическими веществами приводит к образованию вторичных радикалов.
Кавитационные эффекты и их роль в радикальном окислении различных ЗВ наиболее существенны, по-видимому, в океанических и морских водах, а также в глубоководных пресных водоемах.
Фотохимическое инициирование свободных радикалов в природных водах под действием УФ-излучения представлено множеством реакций. Образование радикалов при этом происходит по нескольким механизмам: 1) гомогенное расщепление связи; 2) перенос заряда; 3) фотоэлектронный перенос; 4) через промежуточное образование электронно-возбужденных частиц.
Гомогенное расщепление связи может служить эффективным каналом инициирования радикалов, если квантовый выход при действии солнечного излучения превышает 0,1. Это реакции типа:
– отщепление молекул галогена в галогенированных углеводородах:
hν
R–X → R• + X•;
– разрыв связи в нитроксильных соединениях:
hν
RONO → RO• + NO;
– разрыв О-О связи в пероксидных соединениях:
hν
H2O2 → 2 •OH
hν
ROOH → RO• + •OH
hν
R–C–O–O–C–R → 2R• + 2CO2;
|| ||
O O
– выделение N2 из азосоединеий:
hν
R–N= N–R → 2R• + N2;
– фотолиз нитрат- и нитрит-ионов:
hν
NO2- → NO + O-
hν
NO3- → NO2 + O-.
Фотохимические реакции переноса заряда наиболее существенны для комплексовжелеза: hν
FeOH2+ → Fe2+ + •OH
hν
FeOH22+ → Fe2+ + HO2•
hν
FeOR2+ → Fe2+ + RO•,
а также для некоторых комплексов меди
hν
CuX+ → Cu+ + X•, где
X• – Cl•, Br•, I• и другие лиганды.
Фотоэлектронный перенос весьма распространен в природных водах:
hν O2
S → S+ + eaq- → O2-, где
S – молекула субстрата.
Общая схема реакции с участием электронно-возбужденных частиц может быть представлена в виде:
hν + RH + 2O2
S ↔ 3S* → R• + SH → RO2 + HO2• + S
kT
Зачастую радикалы образуются в результате фотовозбуждения карбонильных групп:
\ hν \
C=O → •С–O(бирадикал)
⁄ ⁄
\ \ +O2
•С–O + RH → •C–OH + R• → RO2•
⁄ ⁄
\ \
•С–OH + O2 → C=O + HO2•
⁄ ⁄
Это пример фотокаталитического образования радикалов. Подобная реакция наиболее вероятна для гумусовых веществ.
Суммируя рассмотренные пути образования свободных радикалов, легко убедиться, что в качестве реакционноспособных частиц образуются гидроксильные радикалы •OH, радикалы О2-, алкильные радикалы R•, быстро переходящие в малореакционноспособные алкилпероксильные радикалы RO2, и алкоксильные радикалы RO•.
Особая роль в радикальных процессах окисления в водной среде принадлежит радикалам •OH и О2-.
2.6.5.4.2 СВОЙСТВА •OH, О2- И ОРГАНИЧЕСКИХ РАДИКАЛОВ
Радикалы •OH – наиболее реакционноспособные окислители в природной воде. Время жизни радикалов •OH в природных водах определяется его участием в реакциях с РОВ:
–отрыв атома водорода от органических соединений
•OH + RH → R• + H2O;
–присоединение по кратной связи
\ ⁄ \ ⁄
•OH + C=C → •C=C–OH;
⁄ \ ⁄ \
–перенос электрона
•OH + 2Br- → Br2- + OH-;
•OH + CO32- → CO3- + OH-;
•OH + NO2-→ NO2 + OH-;
•OH + CH3COO- → CH3COO• + OH-.
В результате суммирования процессов образования и гибели гидроксильных радикалов их стационарная концентрация устанавливается в пределах 10-17 – 10-15 моль· л-1.
В общем случае гидроксильные радикалы взаимодействуют со всеми растворенными в воде органическими и неорганическими веществами. При этом в водной среде образуются вторичные свободные радикалы, последующие превращения которых могут приводить к регенерации •OH.
Радикал О2- обладает двойственной реакционной способностью, т.е. как окислительными, так и восстановительными свойствами. Наиболее характерные реакции О2-:
1) взаимодействие с ионами металлов переменной валентности;
2) как акцептора атома водорода в реакциях с донорами атома водорода;
3) как донора электрона в реакциях с окислителями;
4) диспропорционирование;
5) образование •OH.
Совокупность процессов образования и гибели О2- приводит к стационарной концентрации этого радикала в природных водах на уровне 10-9 – 10-8моль-1· л-1.
В нейтральных водных растворах радикалы О2- наиболее эффективно взаимодействуют с ионами меди:
О2- + Cu2+ ↔ CuO2 ↔ Cu+ + O2
О2- + Cu+ + 2H+ ↔ Cu2+ + H2O2.
Фактически в этих реакциях ионы меди являются катализаторами диспропорционирования радикалов О2-.
Акцептор атомов водорода этот радикал эффективно взаимодействует с такими донорами как гидрохинон, фенолы, некоторые амины:
О2- + DH- → HO2- + D•-.
В реакциях с окислителями А радикал О2- участвует как донор электрона:
О2- + А → О2 + А-.
Наиболее характерны реакции с оксидами азота:
О2- + NO2 → NO2- + O2
О2- + NO → ONOO- + NO3-.
Взаимодействие О2- с H2O2 приводит к образованию гидроксильных радикалов:
О2- + H2O2 → O2 + •OH + OH-.
Одна из основных реакций радикалов О2- – их диспропорционирование:
О2- + 2H+ → О2 + H2O2.
Эта реакция в отсутствие катализаторов вообще не идет. Эффективная константа скорости диспропорционирования О2- зависит от pH среды. В области pH>6 зависимость lgk от pH линейна:
lgk = 12,4 – pH.
В биологических системах диспропорционирование радикалов О2- катализируется ферментом супероксиддисмутазой. Константа скорости ферментативного диспропорционирования О2- составляет 107 – 108 моль-1· л · с-1.
Органические свободные радикалы образуются в ОС в основном в результате вторичных процессов. Органические радикалы обладают чрезвычайно широким спектром свойств и реакционной способностью. По реакционной способности органические радикалы можно подразделить на радикалы-окислители Ro•, восстановители Rr• и на радикалы, обладающие и окислительными и восстановительными свойствами Ror•. Такое разделение носит качественный характер, поскольку окислительные или восстановительные свойства той или иной частицы определяются природой партнера по реакции. Для органических свободных радикалов наиболее характерны следующие реакции.
 2014-01-31
2014-01-31 1314
1314
