Тема 7.1 Химические источники электроэнергии
РАЗДЕЛ 7. Химические источники электроэнергии
Электрохимическими источниками электрической энергии являются гальванические элементы, аккумуляторы, топливные элементы.
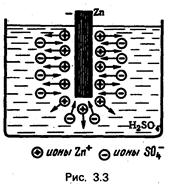
На рис. 3.3 показана цинковая пластинка, опущенная в водный раствор серной кислоты (электролит). Цинк растворяется в электролите, причем в раствор переходят положительные ионы Zn+. Раствор заряжается положительно, а цинк — отрицательно. Растворение цинка обусловлено химическими силами.
В области контакта цинк — раствор появляется электрическое поле образовавшихся ионов, направленное от раствора к цинку.
По мере растворения цинка растет заряд, а вместе с ним и напряженность электрического поля. Электричёское поле противодействует переходу ионов в раствор, поэтому на определенной стадии растворение цинка прекращается.
Такое равновесное состояние соответствует равенству двух сил, действующих на ионы Zn+: химических, под действием которых цинк растворяется, и электрических, препятствующих растворению. Растворение цинка прекращается при наличии некоторой разности потенциалов U1 между цинком и раствором.
|
|
|
Если в тот же раствор поместить пластинку из другого вещества, то описанный процесс будет иметь место и в этом случае. Но полученная разность потенциалов U2 может быть другой величины — больше или меньше U1.
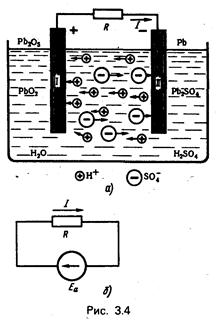
По такому принципу образуется ЭДС гальванического элемента и аккумулятора (рис. 3.4, а, б).
При соединении пласта I и II проводником в замкнутой цепи будет действовать ЭДС химического элемента
Еа = U1 – U2
 и установиться электрический ток.
и установиться электрический ток.
В данном случае ЭДС создается и поддерживается при работе элемента химическими силами (сторонние силы) и, следовательно, можно говорить о преобразовании химической энергии в электрическую.
Электрический ток в гальваническом элементе сопровождается необратимыми электрохимическими процессами, которые можно описать определенными химическими реакциями.
Применение гальванических элементов ограничено — в единицу времени они могут дать лишь незначительное количество электрической энергии, а срок их работы невелик и заканчивается, когда активное вещество электродов в определенной степени будет израсходовано.
Значительно большее применение имеют аккумуляторы, электрохимические процессы которых обратимы. Обратимость электрохимических процессов позволяет проводить многократную зарядку и разрядку аккумуляторов. При зарядке в них накапливается определенное количество химической энергии (за счет израсходованной электрической энергии), а при разрядке эта энергия может быть использована в электрической цепи в виде электрической энергии. Рис. 3.4 соответствует режиму разрядки свинцового аккумулятора.
 2014-01-25
2014-01-25 1101
1101
