Зависимость скорости химической реакции от концентрации описывается кинетическим уравнением. Например, для реакции:,где р, q— эмпирические (найденные экспериментальным путем) коэффициенты, не обязательно совпадающие со стехиометрическими коэффициентами а и b; к — константа скорости реакции, размерность которой зависит от значений р и q.
Константа скорости зависит от тех же факторов, что и скорость химической реакции, но не зависит от концентрации реагирующих веществ.
Величина p + q определяет порядок кинетического уравнения реакции, который показывает, каким образом скорость реакции зависит от концентрации реагентов. Порядок кинетического уравнения может принимать значения 0, 1, 2 и более, он может быть также дробным.
З акон действующих масс:
скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях их стехиометрических коэффициентов.
aA + bB↔сС + dD 



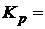
 (РDd·PCc)/(РAa·PBb)
(РDd·PCc)/(РAa·PBb)
а, b, c, d - стехиометрические коэффициенты
Константа равновесия может быть выражена не только через парциальные давления газообразных участников реакции, но и через молярные концентрации и мольные доли исходных веществ и продуктов реакции.
КР= КС (RT)∆n = Кχ (Pобщ) ∆n
КС – константа равновесия, выраженная через концентрации участников реакции
R- газовая постоянная, R=8,314 Дж/(моль К)
∆n-разность количеств вещества конечных и исходных газообразных участников реакции
Кχ– константа равновесия, выраженная через мольные доли участников реакции
Робщ – общее давление.
 2018-03-09
2018-03-09 83
83








