НЕОРГАНИЧЕСКАЯ ХИМИЯ
Программа семинарских занятий
Вопросы и задачи для самостоятельной работы студентов
Настоящее пособие предназначено для студентов 1 курса
Института Химии Санкт-Петербургского Государственного Университета
Основная образовательная программа: 04.03.01 Химия
Санкт-Петербург
2018
Рекомендовано Ученым советом Института химии
Санкт-Петербургского государственного университета
Утверждено на заседании кафедры общей и неорганической химии СПбГУ ## **** 2018 г.
Утверждено на заседании Ученого совета химического факультета СПбГУ ## **** 2018 г.
Составители:
доц. Е. И. Давыдова
доц. Т. Н. Севастьянова
доц. А.А. Селютин
доц. М. Ю. Скрипкин
доц. А. Ю. Тимошкин
доц. В. Д. Хрипун (отв. редактор)
проф. Н. В. Чежина
Рецензенты:
При составлении настоящего пособия было использовано методическое пособие:
НЕОРГАНИЧЕСКАЯ ХИМИЯ для студентов 1 курса химического факультета СПбГУ. Программа семинарских занятий, контрольные вопросы, домашние задания.; Отв. ред. Суворов А. В. СПб. 1999 г. 30 с.
Свойства соединений элементов 17 ой группы
1. Какое положение занимают галогены в Периодической системе элементов? Напишите электронные конфигурации атомов этих элементов и разберите их особенности. Как меняются величины первого потенциала ионизации в ряду галогенов? Постройте схемы МО для молекул F2 и Cl2.
2. Как меняется температура плавления и кипения галогенов и почему?
3. Как меняется прочность молекул Г2 и какие выводы можно сделать из этого о химической активности галогенов?
4. Каковы особенности изменения величин сродства к электрону и электроотрицательности в ряду атомов галогенов и почему?
5. Какие степени окисления проявляют галогены?
6. Каковы способы получения свободных галогенов?
7. Охарактеризуйте окислительно-восстановительные способности галогенов.
8. Охарактеризуйте взаимодействие галогенов с водой, кислотами и щелочами.
9. Как меняется ∆fHo (или ∆fGo) для галогеноводородов в ряду HF – HI? Почему связь в молекулефтороводорода прочнее, чем в молекулах остальных галогеноводородов? Сопоставьте эти закономерности со схемами МО для молекул галогеноводородов.
10. Каковы лабораторные и промышленные способы получения галогеноводородов?
11. Охарактеризуйте кислотно-основные и окислительно-восстановительные свойства галогеноводородов.
12. Какие типы бинарных соединений галогенов с другими элементами Периодической системы Вы знаете? Опишите их свойства и способы получения.
13. Какие формы оксокислотхлора, брома и иода Вам известны? Как изменяется сила кислот в ряду HOCl – HOBr – HOI? Существуют ли эти кислоты в свободном состоянии?
14. Как меняются окислительно-восстановительные свойства оксосоединений галогенов в кислой и щелочной среде? В чем и почему проявляется вторичная периодичность, наблюдаемая у галогенов?
15. Какие электроны атомов галогенов принимают участие в образовании химической связи в следующих соединениях: BrCl, KCl, NaClO4, K2BeF4, KI3, IF5,IF7, Cl2O? Какие типы гибридизации имеет атом галогена в этих соединениях? Каковы геометрические формы молекул и ионов этих соединений?
16. Почему растворы I2 в воде, CCl4, C2H5OH имеют разную окраску?
17. Почему следующие реакции протекают различным образом?
KI(тв) + H2SO4(конц) →
KI(тв) + H3PO4(конц) →
Домашнее задание
1. Закончить уравнения реакций и расставить коэффициенты:
| Cl2 + I2(водный раствор)→ | KI + KNO2 +H2SO4(раствор) → |
| Cl2(газ) + I2(тв) → | KCl + KNO2 +H2SO4(раствор) → |
| F2 + H2O → | KClO3 + KNO2 +H2SO4(раствор) → |
| Cl2 + H2O → | KClO3(тв) +HCl(конц)→ |
| Br2 + NaOH→ | KClO3(тв) + H2SO4(конц) → |
| HCl(конц) + HNO3(конц) → | NH3(газ) + Cl2(газ) → |
| KI(тв) + HNO3(конц) → | PH3(газ)+ Cl2(газ) → |
| CaOCl2(тв) + HI(газ) → | KHal(тв) +H2SO4(конц) → (Hal = F, Cl, Br, I) |
2. Как зависят величины восстановительных потенциалов систем Hal2/Hal– и HalO3–/Hal2 от рН среды? При каком рН в каждом случае эти потенциалы равны (Hal = Cl, Br, I)?
3. Сравните стандартные энтальпии реакций горения одного моля фосфора до высших производных в кислороде, фторе, хлоре, парах брома. Изменится ли последовательность этих величин при замене фосфора на алюминий?
4. Напишите и обоснуйте схемы синтеза следующих веществ: а) свободных галогенов; б) KClO3 из KCl; в) ClO2; г) HIO3 из I2; д) HBr из KBr.
5. Рассмотрите возможность взаимодействия иодида калия с хлором в различных средах и при различных условиях (при комнатной и повышенной температуре, в отсутствие растворителя и в растворах с различным рН, в условиях строгой стехиометрии и при большом избытке одного из реагентов и т.д.). Представьте себе, как Вы проведете опыт в каждом случае, оцените продукты взаимодействия и напишите уравнения реакций.
6. Аналогично рассмотрите возможность взаимодействия хлора с водой.
Свойства соединений элементов 16 ой группы
Общая характеристика халькогенов. Строение атомов. Степени окисления. Аллотропия.
Простые вещества. Характер связи и строение простых веществ, их получение.
Кислород. Общая характеристика. Степени окисления, окислительно-восстановительные свойства. Вода. Пероксид водорода. Пероксидная группировка.
Химия элементов подгруппы серы. Простые вещества. Халькогеноводороды. Электронное строение молекул. Кислотные и восстановительные свойства H2Э.
Оксиды ЭO2 и ЭO3, их кислотно-основные и окислительно-восстановительные свойства. Взаимодействие с водой и щелочами, с кислотами. Получение SO3, SeO3 и TeO3.
Кислоты H2ЭO3 и H2ЭO4. Общая характеристика, электронное и пространственное строение. Кислотно-основные и окислительно-восстановительные свойства. Серная кислота, её получение. Взаимодействие серной кислоты с простым и сложными веществами.
Многообразие кислот серы. Устойчивость кратных связей. Катенация.
Отличие селеновой и теллуровойкислот от серной. Проявление вторичной периодичности в группе халькогенов. Изменение координационного числа халькогена при движении вниз по группе.
Галогениды и оксогалогенидыхалькогенов, способы их получения и взаимодействие с водой и щелочами.
Закономерности изменения химических свойств халькогенов и их соединений при движении вниз по группе.
Химия элементов 16 ой группы
1. Какое положение занимает химический элемент сера в Периодической системе элементов? Изменение основных свойств атомов халькогенов в ПС. Какова электронная конфигурация атома серы, какие степени окисления характерны для неё?
2. Какое явление называется аллотропией? Полиморфизмом? Сравните различные аллотропные модификации кислорода, серы, селена и теллура, в чём их различие? Как осуществляются переходы между различными аллотропными модификациями в простых веществах халькогенов?
3. Приведите примеры реакций, в которых сера проявляет окислительные и восстановительные свойства.
4. Дате характеристику водородным соединениям халькогенов. Вычислите изменения энтальпии, энтропии и свободной энергии Гиббса для реакции образования H2Э. Сравните формы существования и устойчивость данных соединений.
5. Катенация. Полисульфиды.
6. Дайте характеристику кислотно-основных свойств халькогеноводородов. Каковы формы существования H2Э в водном растворе при различных рН?
7. Дайте характеристику окислительно-восстановительных свойств халькогеноводородов. Каковы границы устойчивости существования H2Э в водном растворе при различных рН?
8. Напишите реакции взаимодействия H2O, H2S, H2Se и H2Te с типичными окислителями.
9. Перечислите все известные вам кислородные соединения серы, селена и теллура. Какое строение имеют данные соединения?
10. Какие равновесия устанавливаются при взаимодействии различных кислородсодержащих соединений серы, селена и теллура с водой?
11. Получение серой кислоты. Опишите химические процессы, лежащие в основе данного процесса. Что такое олеум?
12. Многоообразие кислот серы. Перечислите все возможные кислоты серы и их соли. Охарактеризуйте термическую устойчивость этих соединений. Что происходит с ними при нагревании?
13. Тиосульфат натрия и его получение. Приведите реакции, происходящие при фотографическом процессе. Укажите основное отличиепри взаимодействии тиосульфата с хлором и йодом.
14. Галогениды и оксогалогенидыхалькогенов, их термическая устойчивость, устойчивость по отношению к водным растворам кислот и щелочей.
Домашнее задание
1. Закончите уравнения реакций и расставьте стехиометрические коэффициенты:
| KClO3(Δ, MnO2)→ | O3(г) + H2O(ж) → |
| H2O2(aq) + I–(aq) → | SO2(г) + Cl2(ж) → |
| SF6(г) + H2O(l) → | Se(тв) + Cl2(г) → |
| Te(тв) + Na(тв) → | SF4(г) + H2O → |
| S8 + 8O2→ | S8(тв) + S2−(aq) → |
| S8(тв) + 24F2(г) → | S8(тв) + HNO3(aq) → |
| ClO+O3→ | SO3+H2SO4→ |
| Se8+4Cl2→ | Cu2Te+Na2CO3+O2→ |
| TeO2+2NaOH→ | Na2SeO3 + Na2TeO3 + H2SO4 → |
| SOCl2 + Ag2S → | I2 + SO2 + H2O→ |
| H2SeO3 + 2SO2 + H2O→ | SO3 + NO2 + NO→ |
| NO2 + SO2 + H2O→ | SO2 + MnO2→ |
| NaHSO3 + SO2 + Zn→ | SO3+ F2→ |
| SеО3 + 2HCl→ | Fe2(SO4)3 + SO2 + H2O→ |
| TeO2 + KMnO4 + HNO3 + Н2О→ | Te + HClO3 + H2O→ |
| K2S2O3+S2Cl2→ | H2S2O8 + H2O→ |
| S2Cl2 + Cl2→ | SO2Cl2 + H2O→ |
2. Рассчитайте молярную и нормальную концентрацию солей в растворе над осадками сульфидов цинка, свинца, сурьмы и серебра при рН = 0; 7; 14.
3. В какой среде окисление иона SO32– хлором будет протекать легче?
4. Температура пламени горящей серы около 1550 К. Оценит константу диссоциации серного ангидрида на диоксид серы и кислород при этой температуре.
5. Рассмотрите возможность взаимодействия дисульфида натрия с селенатом натрия при различных условиях.
6. Аналогично рассмотрите возможность взаимодействия серы с хлоратом калия.
Химия элементов 15 ой группы
1. Охарактеризуйте положение химического элемента азота в Периодической системе элементов. Запишите электронную конфигурацию атома азота. Изобразите схему МО для молекулы азота. Какова кратность связи в молекуле азота? Чем объясняется химическая инертность молекулярного азота и какими способами можно перевести его в активное состояние? Каковы магнитные свойства азота?
2. Спектрально чистый азот можно получить разложением азида натрия при нагревании. Менее чистый азот получают реакцией термического разложения нитрита аммония. Запишите уравнения указанных реакций. Используя табличные термодинамические данные, рассчитайте ΔHo298, ΔSo298и ΔGo298 этих процессов.
3. Сопоставьте значения энергии ионизации и сродства к электрону атома азота. Какие степени окисления проявляет азот? Приведите примеры соответствующих соединений.
4. Какие типы гибридизации имеет атом азота в следующих соединениях и ионах:NH3, NH4+ NF3, N2O, NO3–, N3–?
5. Одинарные, двойные и тройные связи азота и углерода характеризуются следующими значениями энергии и межатомного расстояния:
| N–N | N=N | N≡N | C–C | C=C | C≡C | |
| Eсв, кДж/моль | 160 | 415 | 946 | 348 | 614 | 839 |
| rсв, Å | 1,47 | 1,25 | 1,10 | 1,54 | 1,34 | 1,20 |
а) Чем объясняется столь существенное различие в устойчивости гомоцепей азота и углерода?
б) Приведите примеры соединений со связями N=N и N–N. Что можно сказать об их устойчивости?
в) В чём причина большей прочности тройной связи в случае азота?
6. Перечислите соединения, которые образует азот с водородом. Приведите их названия, укажите степень окисления азота в каждом из них.
7. Дайте характеристику физических и химических свойств аммиака. Согласно экспериментальным данным, три наиболее низких энергии ионизации молекулы аммиака имеют значения 10,5; 15,2 и 22,4 эВ. Объясните этот факт с использованием метода МО. С чем связаны донорные свойства аммиака? Объясните различие в частотах валентных колебаний связи N–H аммиакатов и в свободной молекуле аммиака:
| NH3 | [Co(NH3)6]3+ | [Cr(NH3)6]3+ | [Cu(NH3)4]2+ | |
| ν(N-H), см–1 | 3414 | 3320 | 3320 | 3327 |
8. Каковы условия синтеза аммиака из простых веществ? Будет ли изменяться выход аммиака при увеличении давления, температуры, при наличии катализатора?
9. Вычислите энергию Гиббса ΔGo298 для реакции синтеза аммиака и константу равновесия (Кр) при стандартной температуре и при 600 К.
10. Обсудите, что происходит при растворении аммиака в воде. Какие молекулы и ионы существуют в водном растворе аммиака? Какой это электролит: сильный или слабый? Значение сродства к протону для молекулы аммиака 9,3 эВ, а для воды 7,9 эВ. Известно, что столь неодинаковые по силе в воде уксусная и хлорная кислоты в жидком аммиаке полностью ионизированы. Почему в жидком аммиаке различия в силе кислот нивелируются? Запишите уравнение автоионизации аммиака. Чему равна константа равновесия этого процесса при 298 К?
11. Каково строение иона аммония? Используя термодинамические данные, оцените температуру термического разложения хлорида аммония. Как Вы полагаете, карбонат аммония разлагается легче или труднее, чем хлорид? Дайте объяснения. Составьте уравнения реакций термического разложения солей аммония: хлорида, карбоната, дигидрофосфата, дихромата, нитрита и нитрата. Как влияет природа аниона на характер разложения солей аммония?
12. Приведите примеры нитридов. Охарактеризуйте, какие из них являются ковалентными, ионными, металлоподобными?
а) Как ведут они себя по их отношению к воде?
б) Нитриды каких элементов отличаются особой жаростойкостью и химической инертностью? На чем основано и для чего проводится азотирование металлов и сплавов?
в) Какие применения нитридов Вам известны?
13. Приведите формулу гидразина. Ниже даны некоторые его характеристики: Тпл = 2оС; Ткип = 114оС; μ =1,85∙10–29Кл∙м; ΔсгорНо = –622 кДж/моль.
а) Опишите строение молекулы гидразина, объясните его агрегатное состояние, автоионизацию в жидком состоянии, способность к образованию солей гидразония, окислительные и восстановительные свойства, реакции его получения.
б) вычислите тепловой эффект сгорания 0,1 кг гидразина;
в) Какие свойства обуславливают применение гидразина как ракетного топлива?
14. Вычислите термодинамические характеристики процессов окисления аммиака и свободного азота кислородом, сопоставьте их и обсудите возможности практического осуществления этих процессов.
15. Напишите формулы всех оксидов азота. Рассмотрите строение молекул оксидов, гибридизацию атома азота, в чем причина полимеризации некоторых из них? Почему при взаимодействии простых тел образуется только один оксид – монооксид? Какие оксиды азота являются кислотными?
16. Приведите схему молекулярных орбиталей для молекулы NO и молекулярных ионов NO+и NO–. Найдите значения межъядерного расстояния и энергии диссоциации этих соединений.
а) Какая тенденция – потеря или присоединение электрона –более предпочтительна при химических превращениях молекулы NO? Почему?
б) Объясните различие межъядерных расстояний, энергий диссоциации и частот валентных колебаний молекулы NO (1909 см–1) и иона NO+ (2277см–1).
в) Продукты, образующиеся при реакциях
2NO + Cl2 = 2NOCl
6NO + 8BrF3 = 6NO[BrF4] + Br2
характеризуются следующими свойствами: NOCl – газ (Тпл = –62оС;
Ткип=–7оС; ν(N-O) = 1800 см–1), NO[BrF4] – кристаллическое вещество
Тпл = 255оС; в жидком состоянии – проводник; ν(N-O) = 2300 см–1). В каком из этих соединений группа NO связана ковалентно, в каком находится в виде иона NO+?
г) Рассчитайте энтальпию образования NO, исходя из энергии диссоциации N2, O2 и NO.Объясните, почему энтальпия образования NOэндотермична.
д) Почему подожженные фосфор, углерод и сера продолжают энергично гореть в NO? Запишите уравнения протекающих реакций и вычислите изменение свободной энергии Гиббса в этих процессах.
е)Приведите уравнения реакций и обоснуйте условия получения NO в промышленности и в лаборатории.
17. Опишите структуру фторида, оксогалогенидов, оксида азота (III) и объясните их агрегатное состояние в обычных условиях. Приведите реакции, иллюстрирующие кислотно-основные свойства этих соединений.
18. Приведите примеры реакций, демонстрирующих окислительные, восстановительные свойства иона NO2–, а также примеры реакций диспропорционирования.
19. МолекулаNO2 характеризуется следующими константами:
μ =0.097∙10–29Кл∙м; <ONO = 132o, r(NO) =1,20 Å,E(NO) = 468,8 кДж/моль.
а) Составьте электронную конфигурацию молекулы NO2 (см.рис.1) и её структурную формулу.

Рис.1.Приближенные энергетические диаграммы орбиталей треугольной (а) и уголковой (б) молекул с π-связями.
б) Почему в ИК спектре молекулы NO2 наблюдается три полосы поглощения, тогда как у молекулы NO – одна (рис.2)

Рис.2. Валентные и деформационные колебания связей соединений азота.
20. Возможно ли образование NO2 из простых веществ? Приведите примеры реакций получения NO2 в технике и в лаборатории. Почему в атмосфере NO2 горят многие металлы и неметаллы?
21. После поглощения NO2 раствором щелочи были выделены продукты, ИК-спектры которых представлены на рис.3.

Рис.3.ИК-спектры соединений азота
а) Пользуясь рис. 2, определите, к каким соединениям относятся эти спектры.
б) Напишите уравнения реакций взаимодействия NO2 с гидроксидами щелочных металлов. Для каких целей используются эти реакции в промышленности?
22. Самоионизация жидкого N2O4 представлена процессом:
N2O4=NO+ + NO3–, что позволяет использовать N2O4 в качестве ионизирующего растворителя для получения безводных нитратов металлов.
а) Напишите уравнения взаимодействия с жидким N2O4 1) цинка; 2) калия.
б) Охарактеризуйте, какие свойства – кислотные или основные – проявляют NOCl и AgNO3 в жидком N2O4? Напишите уравнение взаимодействия NOCl и AgNO3, растворенных в жидком N2O4.
в) Каким образом получить жидкий N2O4?
23. В ИК-спектрах твердого оксида азота (V) проявляются следующие частоты колебаний: 1400, 538, 2375 см–1 и 1050, 824, 1413, 722 см–1. Каким ионам отвечают эти частоты? Как построены кристаллы N2O5?
24. Чем можно объяснить, что азотная кислота более сильная и термически более устойчивая, чем азотистая?
25. Сравните термическую устойчивость следующих соединений: HNO2, HNO3, KNO3, Pb(NO3)2, AgNO3. Почему кислоты и их соли тяжелых металлов менее устойчивы, чем соли щелочных металлов?
26. В ионе N3–межъядерные расстояния равны и составляют 1.15Å, а в молекуле HN3 межъядерные расстояния азот-азот составляют 1,13 и 1,24 Å.
а) Чем объяснить указанное различие?
б)Почему ионные азиды термически значительно устойчивее ковалентных?
27. Какое положение занимает химический элемент фосфор в Периодической системе? Напишите электронную конфигурацию атома фосфора. В чем состоит и чем объясняется отличие свойств азота и фосфора?
28. Какие орбитали фосфора принимают участие в образовании химических связей с другими элементами в таких соединениях и ионах, как:PH3, PH4+, P4, PCl3, PF6–, PCl5, PO43–, HPO32–?
29. Как получают фосфор в свободном состоянии из природных соединений?
30. Какие соединения образует фосфор с водородом? Как построены фосфористые водороды? Чем можно объяснить особую растворимость фосфина в воде?
31. а) Приведите, сопоставьте и объясните различия следующих характеристик фосфина и аммиака: длина связи, энергия связи, валентный угол, дипольный момент.
б) Исходя из строения молекул фосфина и аммиака, сравните их устойчивость, электронодонорные, восстановительные свойства, температуры плавления и кипения.
в) Возможно ли образование фосфина из простых веществ? Приведите реакции получения фосфина.
г) Как объяснить меньшее сродство к протону молекулы РН3 (8,0 эВ) по сравнению с NH3 (9,0 эВ)? Как это сказывается на свойствах фосфина и производных иона фосфония по сравнению со свойствами аммиака и иона аммония?
32. Каков состав и каковы структуры фосфористого и фосфорного ангидридов? Существует ли разница в продуктах взаимодействия фосфористого ангидрида с холодной и горячей водой?
33. Каковы состав и основностьфосфорноватистой и фосфористой кислот?
34. Какие процессы происходят при гидратации фосфорного ангидрида? Какими качественными реакциями можно различить мета-, орто- и пирофосфорные кислоты и их соли?
35. Объясните различную величину рН растворов при гидролизе одно-, двух- и трехзамещенных фосфатов натрия.
36. Какие вещества получаются при взаимодействии три- и пентахлорида фосфора с водой? К какому классу соединений относятся эти соединения фосфора?
37. Дайте общую характеристику подгруппы мышьяка. Как можно получить соединения мышьяка, сурьмы и висмута в высшей степени окисления? Проследите, как меняются устойчивые формы существования элементов 15 группы в высшей степени окисления и какова тенденция в изменении их окислительных свойств.
38. Проиллюстрируйте изменение химической природы простых веществ в ряду P–As–Sb–Bi на примере их взаимодействия с азотной кислотой.
39. Как получают гидроксиды сурьмы и висмута и какими свойствами они обладают?
40. Хлориды элементов подгруппы мышьяка сильно гидролизуются в растворе. Как изменяется характер продуктов и степень гидролиза при переходе от трихлорида мышьяка к трихлориду висмута?
41. Какие вещества образуются при действии воды на трихлорид и нитрат висмута? Как готовят растворы этих солей висмута?
42. Приведите примеры соединений висмута (V) и охарактеризуйте их химическое поведение.
43. Сравните кислотно-основные и окислительно-восстановительные свойства водородных соединений азота, кислорода и фтора.
44. Сравните кислотно-основные и окислительно-восстановительные свойства соединений элементов II периода, содержащих одинарную гомоядерную связь.
Домашнее задание
1. Закончить и уравнять следующие реакции:
P + HNO3(конц) → P + NaOH→
As + HNO3(конц) → Bi + NaOH→
Sb + HNO3(конц) → As + H2SO4 (конц)→
Bi + HNO3(конц) → As + H2SO4 (конц)→
P2O3 + HCl → P2O3 + HNO3→
P2O3 + NaOH → Bi2O3 + NaOH →
Sb2O3 + HCl → Sb2O3 +HCl + Zn →
Sb2O3 + HNO3(конц) → Bi2O3 + HNO3 →
Sb2O3 + NaOH → Bi2O3 + HCl→
HNO3(разб) + Zn → HNO3(конц) + HCl →
NH3 + O2→ PH3 + O2→
NO2 + H2O→ NOCl + H2O→
KNO2 + NaBiO3 + H2SO4→
2. Рассчитайте величины восстановительного потенциала системы
NO3–/NO2(газ), Eo = + 0,77 В:
а) при рН = 0, 3, 7, если [NO3–] = 1 моль/л, p(NO2) = 1атм.
б) при [NO3–] = 0,01; 0,1; 1 моль/л, если p(NO2) = 1атм.
Постройте график зависимости Е(NO3–/NO2(газ)) = f(lg[NO3–])
3. Напишите и обоснуйте схемы синтеза следующих веществ:
а) HNO3 изN2; б)H3PO3 из Ca3(PO4)2; в)Sb2O3 из SbCl3; г) BiCl3 из Bi(NO3)3; д) AsH3 из As.
4. Запишите реакции взаимодействия с водой следующих соединений: фторид азота; хлорид азота; хлорид фосфора (III); оксохлорид фосфора (V); оксид фосфора (V); оксид фосфора (III); хлорид сурьмы (III), хлорид сурьмы (V); хлорид висмута.
5. Рассмотрите возможность взаимодействия фосфора с хлором в различных средах и при различных условиях (при комнатной и при повышенной температурах, в отсутствии растворителя и в растворах с различными значениями рН, в условиях строгой стехиометрии, при большом избытке одного из реагентов и т.п.). Представьте себе, как Вы проведете опыт в каждом случае, оцените продукты взаимодействия и напишите уравнения соответствующих реакций.
6. Аналогичным образом рассмотрите возможность взаимодействия мышьяка с йодом.
Химия элементов 14 ой группы
1. Какое положение занимают химические элементы 14 группы в Периодической системе? Какова электронная конфигурация атома каждого элемента? Каковы возможные степени окисления этих элементов?
2. Как изменяются атомные радиусы в ряду C–Si–Ge–Sn–Pb? Как изменяются по группе кислотные свойства высших оксидов?
3. В чём главная особенность химического элемента углерода? Что отличает 14 группу Периодической системы от других групп?
4. Объясните, будет ли устойчива молекула C2 при обычных условиях?
5. Объясните образование тройной связи в молекуле COс использованием методов ВС и МО.
6. Какую кристаллическую решётку образуют атомы углерода в алмазе и графите?
7. Какие орбитали атома углерода принимают участие в образовании связей в соединениях CH4, C2H4, CCl4, CO, CO2, CO32–? Какова гибридизация атома углерода в каждом соединении? Какой тип связей (σ, π) реализуется в них? Какова пространственная конфигурация этих молекул?
8. Обсудите равновесие, устанавливающееся при растворении углекислого газа в воде. Как влияет добавление кислот или щелочей на это равновесие?
9. Карбонаты различных металлов разлагаются при самых разных температурах. Чем это можно объяснить?
10. Каковы окислительно-восстановительные свойства оксида углерода(II)?
11. Какие соединения называются карбидами металлов? Почему соединение кальция с углеродом называется ацетиленидом кальция? Какова разница в структуре карбидов кальция и алюминия?
12. Объясните, можно ли хранить плавиковую кислоту в стеклянной посуде? Предложите несколько способов перевода SiO2в растворимые соединения.
13. Как из кварцевого песка получить: кремний, тетрафторид кремния, силикат натрия? Напишите уравнения соответствующих реакций.
14. Сравните физико-химические свойства (строение, устойчивость, отношение к воде) и обсудите причины их различия для аналогичных по составу соединений углерода и кремния: CO2–SiO2, CH4–SiH4, CCl4–SiCl4, CF4–SiF4.
15. Какие координационные числа проявляют углерод и кремний в соединениях с кислородом и другими элементами?
16. Дайте общую характеристику элементов подгруппы германия.
17. Каково положение олова и свинца в ряду напряжений? Как они реагируют с кислотами и щелочами?
18. Какими реакциями можно перевести олово в α- и β-оловянные кислоты, в станнит натрия, в оксид олова?
19. При растворении в воде хлорида олова(II) в систему добавляют соляную кислоту и металлическое олово. Какое значение имеет добавление каждого из этих веществ? Напишите уравнения соответствующих реакций.
20. Охарактеризуйте кислотно-основные свойства гидроксидов Sn(II) и Pb(II). В чём их различие?
21. Какая из солей–Pb(NO3)2 или Sn(NO3)2–гидролизуется сильнее?
22. Какое соединение –SnCl2 или SnCl4–гидролизуется сильнее? Почему?
23. Какой из гидроксидов – Sn(II) или Sn(IV) – обладает более сильными основными свойствами?
24. Как можно получить из свинца оксид и диоксид свинца, а из диоксида – оксид свинца?
25. Объясните, почему для разделения смеси сульфидов PbS и Sb2S3 можно использовать растворы сульфида аммония (NH4)2S или полисульфидааммония (NH4)2S2. Напишите уравнения соответствующих реакций.
Домашние задания
1. Закончите и уравняйте следующие реакции:
C + CO2® CO2 + NaOH®
CO + NaOH® C (Si, Ge, Sn, Pb) + HNO3®
CO + Na2CO3 + NH3® Sn + HNO3(конц.) + HCl(конц.)®
K2CO3 + HCl® K2CO3 + HNO3®
K2CO3 + H2O ® CaC2 + H2O ®
BeC2 + H2O ® C + H2SO4(конц.) 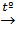
Pb + SnCl4 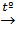 Sn + Cl2
Sn + Cl2 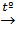
Pb + Cl2 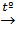 SnCl4 + KOH(избыток)®
SnCl4 + KOH(избыток)®
SnCl4 + Na2CO3  SnI2 + HNO3(конц.)®
SnI2 + HNO3(конц.)®
PbI2 + KClO3 + HNO3® GeCl4 + H2O ®
Pb3O4 + HCl®
2. Какой элемент окисляется в реакции:
SiH4 + Cl2(избыток)®
CS2 + O2(избыток)®
3. Как будут протекать реакции:
а) при добавлении нескольких капель разбавленной серной кислоты в стакан с концентрированным раствором Na2CO3;
б) при добавлении нескольких капель того же раствора соды в стакан с разбавленной серной кислотой?
4. Напишите и обоснуйте схемы синтеза следующих веществ: а) CO; б)SiCl4 из SiO2; в) SnSO4; г) PbO2; д) K2SnCl6.
5. Рассмотрите возможность взаимодействия кремния с хлороводородом в различных средах и при различных условиях (при комнатной и повышенной температурах, в отсутствие растворителя и в растворах с различным значением рН, в условиях строгой стехиометрии, при большом избытке одного из реагентов и т.п.). Представьте себе, как Вы проведёте опыт в каждом случае, оцените продукты взаимодействия и напишите уравнения соответствующих реакций.
6. Аналогично п.5 рассмотрите возможность взаимодействия оксида олова(II) с дисульфидом натрия.
7. Определите, будут ли соединения олова(II) восстанавливать Bi(OH)3 при pH = 14 если известно, что Eº([Sn(OH)6]2–/[Sn(OH)6]4–) =–0,93 В; Eº(Bi(OH)3/Bi) = –0,45 B. Ответ подтвердите расчетом DEº. Напишите уравнение реакции взаимодействия Na4[Sn(OH)6] с Bi(OH)3.
8. Будет ли выпадать осадок SnS при прибавлении к 10 мл 0,002 М раствора дихлорида олова к 20 мл 0,001 М раствора сульфида натрия?
Химия элементов 13 ой группы
1. Какое положение занимают бор и алюминий в Периодической системе элементов? Напишите электронные конфигурации атомов этих элементов и укажите, какие степени окисления они проявляют.
2. Постройте схему МО молекулы В2. Каков порядок связи и каковы магнитные свойства этой молекулы. В каких условиях она существует?
3. Как получить бор в свободном состоянии? Какие Вы предлагаете реакции для характеристики свойств бора?
4. Как получить борный ангидрид? Как объяснить тот факт, что из раствора буры можно получить борную кислоту?
5. Объясните, что происходит при нейтрализации борной кислоты щелочью.
6. Изобразите графическую формулу и предложите способ получения борнометилового эфира.
7. Напишите уравнение гидролиза тетрабората натрия (две стадии).
8. Какой состав имеет «ювелирная бура» и что такое «перл буры»?
9. Каков состав простейшего борана? К какому классу боранов он относится? Каково его строение? В чем заключаются особенности химической связи в нем?
10. Какое положение занимает алюминий в ряду напряжений металлов? Как он относится к кислороду воздуха, воде, кислотам и щелочам? Почему алюминий не реагирует с холодной азотной кислотой?
11. Какими свойствами обладает гидроксид алюминия?
12. Можно ли выделить из водного раствора сульфид, сульфит и карбонат алюминия?
13. Какое соединение сильнее гидролизуется в водном растворе: сульфат или сульфид алюминия?
14. В какой форме существует в парах хлорид алюминия? Рассчитайте константу равновесия 2AlCl3(г) = Al2Cl6 (г) при 100 и 400 ºС.
15. Объясните образование молекулы Al2Cl6 с точки зрения метода валентных связей.
16. Как можно получить гидрид алюминия? Какова его структура? Какими свойствами он обладает?
17. Сравните свойства бора и алюминия. На какой элемент похож бор?
18. Дайте характеристику элементов подгруппы галлия.
19. В чем заключается основное отличие химии таллия от его аналогов по группе? Чем оно обусловлено?
20. Рассмотрите кислотные свойства галогенидов 13 группы. Как они меняются по ряду элементов 13 группы? По группе галогенов?
Домашнее задание
1. Закончите и уравняйте химические реакции:
B + HCl→ KAl(SO4)2 + K2S (р-р) →
Ga + HCl→ Tl(NO3)3 + K2S (р-р) →
B + HNO3→ KAlH4 + O2→
Al + HNO3→ KAlH4 + HCl (р-р) →
Na2B4O7 + Mg → LiBH4 + Cl2→
KCl + AlCl3→ Tl + Cl2→
AsH3 + GaCl3→ Ga + GaCl3→
2. Напишите уравнения реакций гидролиза следующих солей и укажите реакцию раствора:Al(NO3)3, GaCl3, Tl2CO3, Na3BO3.
3. Вычислите степень гидролиза по первой ступени в 0.05 М растворах сульфатов алюминия, галлия и индия (К3 для М(ОН)3 равны 10–9, 10–11, 10–10 для гидроксидов алюминия, галлия и индия, соответственно).
4. Напишите и обоснуйте схемы синтеза следующих веществ: а) В из Na2B4O7; б) GaCl3 (безв) из Ga; в) Al2S3; г) Tl2(SO4)3 из Tl.
5. Рассмотрите возможность взаимодействия нитрата алюминия и сульфида натрия в различных средах и при различных условиях (при комнатной и повышенной температурах, в отсутствии растворителя и в растворах с различным значением рН, в условиях строгой стехиометрии, при большом избытке одного из реагентов, и т.п.). Укажите как Вы проведете опыт в каждом случае, определите продукты взаимодействия и напишите уравнения соответствующих реакций.
6. Аналогично рассмотрите взаимодействие трихлорида алюминия с аммиаком.
Химия элементов 1 ой и 2 ой группы
1. Какое положение занимают в Периодической системе элементов щелочные и щелочноземельные металлы? Напишите электронные конфигурации атомов этих элементов и укажите, какие степени окисления они проявляют.
2. Что такое натриды и электриды? Приведите примеры. В каких условиях они существуют? Какие степени окисления проявляет натрий в этих соединениях?
3. Как выделить щелочные и щелочноземельные металлы в свободном состоянии?
4. Какие степени окисления проявляют элементы в следующих соединениях: Na2O2, BaO2, KO2, KO3? Как можно получить эти соединения?
5. Охарактеризуйте отношение щелочных и щелочноземельных металлов к воде, растворам кислот и щелочей.
6. Сравните химические свойства лития со свойствами натрия и магния. С каким элементом более схож литий? Почему?
7. Обсудите геометрические характеристики газофазных молекул галогенидов элементов 2 группы MX2. Каково значение валентного угла
X–M–X? Чем обусловлена нелинейность молекул некоторых галогенидов?
8. В вакуумных системах для удаления остаточных количеств воздуха иногда используют геттеры (вещества, химически реагирующие с остаточными газами с образованием нелетучих продуктов). Какие три металла из элементов 1 и 2 группы могут служить геттерами? Напишите уравнения реакций, протекающих при работе этих геттер. В чем заключается основной недостаток использования геттер для создания высокого вакуума?
Домашнее задание
1. Закончите и уравняйте химические реакции:
Li + O2→ Na + O2→
Ba + O2→ Cs + O2→
Ca + O2→ Ca + O2→
CaCl2 + CO2→ Ca(OH)2 + CO2→
NaNO3→ LiH + SO2→
Ba(NO3)2→ Na2O2 + F2→
BeC2 + HCl→ Be2C + HCl→
2. Какой щелочной металл будет наиболее сильным восстановителем в реакции: а) с кислородом; б) водой; в) хлором? Ответ подтвердите расчетом.
3. Обсудите преимущества и недостатки технологии производства соды по Леблану и по Сольве. Напишите уравнения реакций, лежащих в основе каждого способа.
4. Какой реагент более эффективен при устранении постоянной жесткости воды – сода или ортофосфат натрия? Ответ обоснуйте расчётом.
5. Напишите и обоснуйте схемы синтеза следующих веществ: а) К из природного сырья; б) Na2O2; в) Ca3P2.
Химия 18 ой группы (благородные газы).
1. Напишите электронные конфигурации элементов 18 группы в основном электронном состоянии. Какие степени окисления проявляют эти элементы?
2. Опишите природу химической связи в соединениях благородных газов.
3. Охарактеризуйте кислотно-основные и окислительно-восстановительные свойства оксидов благородных газов и соответствующих им кислот.
4. Опишите особенности комплексных соединений благородных газов. Какие координационные числа характеры для этих элементов?
5. Рассмотрите методы выделения и разделения благородных газов.
6. Приведите примеры соединений
а) со связью благородный газ – благородный газ;
б) со связью благородный газ – благородный металл.
Домашнее задание.
1. Закончите и уравняйте химические реакции:
Xe + HCl→ Xe+ F2 (изб)→
Xe + O2→ Na4XeO4→
Kr + F2→ XeF6 + NaOH→
XeF4 + NaOH→ XeF2 + NaOH→
2. Рассмотрите методику получения высшего оксида ксенона из ксенона.
3. Рассмотрите методику получения перксената натрия из гексафторида ксенона.
4. На столе стоят три стакана: 1) с водой; 2) с 5М раствором щелочи; 3) с 5М раствором соляной кислоты. В каждый стакан внесли небольшое количество безводного тетрафторида ксенона и тщательно перемешали. Опишите происходящие процессы. Решите задачу, заменив XeF4 на KrF2, XeO3.
Введение в координационную химию
1. Какие магнитные свойства частицы связаны с ее электронным строением?
2. Может ли быть атом или ион диамагнитным, парамагнитным, ферромагнитным?
3. Основные положения теории Вернера. Понятие внутренней и внешней сферы, координационного числа. Может ли комплексное соединения не иметь в своем составе внешней координационной сферы?
4. Какие типы изомерии есть в комплексных соединениях? Приведите примеры различных изомеров.
5. Сколько различных изомеров можно ожидать для соединений МА4(ВВ) и МА2(ВВ)2, если А –монодентантныйлиганд, а ВВ – бидентантный?
6. Назовите каждое из следующих соединений:
[Co(NH3)3(aq)3]2(SO4)3 [Mo2(CH3COO)4]
K4[Ni(CN)4] Na2[Ni(edta)]
Pt(en)2Cl2; Na2[Fe(NO)2(CN)4] K4[(C2O4)2Co(OH)2Co(C2O4)4]
Для какого из этих соединений существуют пространственные изомеры?
7. Напишите формулы для каждого из следующих соединений:
тетраамминдибромрутений (III) сульфат;
аквахлоро-бис-(этилендиамин)родий (III) хлорид;
кальция диамминдиоксалатокобольтат (III);
транс-диглицинатопалладий (II);
окстааммин-μ-гидроксокобальта (III) сульфат.
В каких названиях допущены ошибки?Напишитеправильные названия соединений.
8. Сформулируйте основные положения методов описания электронного строения комплексных соединений: метода валентных связей, теории кристаллического поля, теории поля лигандов. Какие преимущества и недостатки есть у каждого из этих методов?
9. Изобразите с позиции ТКП характер расщепления d-орбиталей центрального иона в октаэдрическом, тетраэдрическом и плоскоквадратном полях.
10. Дайте определение энергии экстрастабилизации полем лигандов (ЭСПЛ).
11. Теорема Яна-Теллера для комплексных соединений. В случае каких конфигураций центрального ионаdn в октаэдрическом поле возникает эффект Яна-Теллера? В каких случаях будет наблюдаться сильный, а в каких слабый эффект Яна-Теллера? Может ли этот эффект наблюдаться в случае другого пространственного строения комплексной частицы?
12. Изобразите энтальпийную диаграмму образования комплексного иона CrCl63– по реакции Сr(крист) + 3 Cl2 (газ) + 3ē = CrCl63– с учетом ЭСПЛ.
13. Для какой конфигурации dn и каких состояний комплексов (высоко- и низкоспиновых) ЭСПЛ в тетраэдрическом поле будет больше, чем в октаэдрическом?
14. Для какой конфигурации dn и каких состояний комплексов (высоко- и низкоспиновых) предпочтительнее образование плоскоквадратных частиц?
15. Какой из изомеров будет предпочтительнее с позиций ТКП: [Co(NH3)6][CuCl4] или [Cu(NH3)6][CoCl4]?
16. Спектрохимичский ряд лигандов. Как объяснить положения лигандов в этом ряду с позиций ТКП? С позиций ТПЛ? Постройте схемы МО комплекса, содержащего лиганды разного типа (σ, π – доноры, σ, π – акцепторы).
17. Какие лиганды обладают π-акцепторной способностью? За счет каких особенностей электронного строения лигандов эта способность проявляется? Какие изменения наблюдаются в структуре комплексной частицы, содержащей π-акцепторный лиганд?
18. Рассмотрите правила Сиджвика. Объясните правило с позиций электронного строения комплексов. Приведите примеры комплексов, соответствующих этому правилу. Какие свойства могут провялятся у комплексов, не подчиняющихся данному правилу?
19. Чем в общем случае определяется инертность и лабильность комплексной частицы?
20. В чем различие механизмов обменалигандовSN1 и SN2?
21. Транс -эффект Черняева. Объясните ряд транс -влияниялигандов с позиций электронного строения комплексов. В чем разница между транс -эффектом и транс -влиянием?
22. Будет ли скорость обмена ML3X + X = ML2X2 + L зависеть от положения лиганда Х в ряду транс -влияния?
23. Что такое «хелатный эффект»? В чем он проявляется? Что такое «макроциклический эффект»?
Домашнее задание
1. Какое максимальное количество изомеров может быть у комплекса брутто-состава CoCl2Br∙4NH3?
2. Определите ЭСПЛ в единицах ΔО для комплексов Mn2+, Co2+, Co3+, Fe3+, Cu2+, Cr2+ в октаэдрическом и тетраэдрическом окружении в случае лигандов сильного и слабого поля, считая ΔТ= 4/9ΔО. Для какого окружения и для какого иона величина ЭСПЛ максимальна, а в каком случае минимальна?
3. Какова ЭСПЛ для следующих комплексов:
d5 – низкоспиновыйоктаэдрический,
d8 – высокоспиновыйоктаэдрический,
d7 – тетраэдрический,
d5 – высокоспиновыйоктаэдрический?
4. Предскажите геометрию следующих ионов:
[Co(CN)6]3– – диамагнитный,
[Ni(CN)4]2– – диамагнитный,
[NiF6]4– – два неспаренных электрона,
[СrF6]4– – четыре неспаренных электрона,
[AuCl4]– – диамагнитный,
[FeCl4]– – пять неспаренных электронов.
Оцените величину магнитного момента этих частиц в магнетонах Бора.
5. Напишите последовательные и общие константы устойчивости следующих комплексов: [Ni(CN)4]2–, [Ag(NH3)2]+, [Cr(en)3]3+, [FeCl4]–.
Предскажите, какая из последовательных констант будет самой большой, а какая самой маленькой. Сопоставьте Ваш вывод с экспериментальными данными.
6. В 100 мл воды были растворены 1,00∙10–3 моль dienNH(CH2CH2NH2)2 и 5,00∙10–3 моль Ni(ClO4)2. Вычислите концентрацию [Ni(dien)]2+, Ni2+ и [Ni(dien)2]2+, предположив, что концентрация Ni(dien)2]2+ много меньше, чем Ni2+ либо [Ni(dien)]2+. Константы устойчивости равны: K1=5,0∙1010, K2=1,6∙108.
 2018-03-09
2018-03-09 585
585







