1. Напишите электронные конфигурации атомов 3d-элементов и покажите, чем отличаются конфигурации атомов хрома и меди от остальных элементов ряда. Какие степени окисления проявляет каждый из 3d-элементов?
2. Основываясь на электронном строении атома, предскажите характер изменения температур плавления в ряду титан – хром – кобальт. Сопоставьте предсказанный ход температуры плавления с экспериментальными данными.
3. Проанализируйте сходство и различие в свойствах (кислотно-основных, окислительно-восстановительных, устойчивости, инертности) монооксидов МО элементов первого переходного ряда.
4. Аналогично проанализируйте сходство и различие в свойствах диоксидов МО2 элементов первого переходного ряда.
5. Среди каких оксидов: МО или МO2 – больше соединений переменного состава? Чем это можно объяснить?
6. Есть ли различие в понятиях “фаза переменного состава” и “соединение переменного состава”?
7. Почему соединения переменного состава не встречаются среди высших оксидов, таких как М2О5, МО3 или М2О7?
8. Оцените температуры, при которых константы равновесия восстановления монооксидовTi, V, Mn, Fe, Co, Ni, Cu, Zn водородом c образованием металлов равны 1. Определите, какие из приведенных металлов могут, а какие не могут быть получены таким путем в реальных условиях (при Т < 1500 К).
9. Одним из методов очистки металлов, в том числе титана и ванадия, является метод иодидного рафинирования, предложенный Ван Аркелем и де Буром. Какие реакции лежат в основе данного метода? Оцените температуру горячей зоны, которую необходимо поддерживать при рафинировании титана.
10. Диоксид титана существует на Земле в виде трех основных полиморфных модификаций – рутил, анатаз и брукит. Какая из них термодинамически наиболее устойчива? Почему за время существования Земли еще не весь диоксид титана перешел в эту модификацию?
11. Предложите 2-3 способа перевода диоксида титана в водорастворимое соединение. Какой из них представляется Вам оптимальным?
12. При восстановлении диоксида титана водородом при температуре 9000С получается темно-голубое вещество Ti3O5. Предположите, какие соединения будут образовываться при его взаимодействии с концентрированной соляной кислотой.
13. Оксид ванадия(V), полученный нагреванием ванадата аммония в тигле, накрытом крышкой, имеет более темную окраску, чем полученный при нагревании в открытом тигле. Объясните данный факт.
14. В три стакана, содержащие раствор сульфата меди, добавили (а) небольшое количество разбавленного раствора едкого натра; (б) эквивалентное количество горячего раствора щелочи; (в) эквивалентное количество холодного раствора щелочи. Во всех трех стаканах выпали осадки, но их цвета различны. Приведите уравнения протекающих реакций и укажите цвета образующихся осадков.
15. Для всех элементов первого переходного ряда (кроме цинка) известны соединения, образованные ионами М3+. Проанализируйте сходство и различие свойств таких соединений: их отношение к воде, кислотам, щелочам, окислителям, восстановителям. Приведите примеры соответствующих реакций и составьте их уравнения.
16. Расположите приведенные ниже ионы в ряд по увеличению степени гидролиза в 0.1 М растворах соответствующих нитратов:
1) Сr3+; 2) Fe3+; 3)Ti3+; 4) Sc3+; 5) V3+.
17. При растворении фиолетовых кристаллов нонагидрата нитрата железа(III) Fe(NO3)3∙9H2O в воде образуется желто-бурый раствор, при кипячении которого образуется красно-бурый хлопьевидный осадок. Напишите уравнения реакций, объясняющих данные изменения.
18. Какие из приведенных ниже частиц термодинамически неустойчивы в стандартной кислой среде:
1) Cr3+; 2) MnO42-; 3) Ti3+; 4) Fe2+; 5) Mn3+
19. Какие из приведенных ниже частиц термодинамически неустойчивы в стандартной щелочной среде:
1) MnO2; 2) Cr(OH)2; 3) Fe(OH)2; 4) Co2O3∙nH2O; 5) NiO2.
20. Объясните, почему при взаимодействии перманганата калия с соляной кислотой получается хлор, а при замене соляной кислоты на раствор хлорида цезия той же концентрации хлор не выделяется.
21. В водном растворе трихлорид титана уже при обычных условиях легко окисляется кислородом воздуха. Составьте уравнения реакций его окисления в сильно кислом и в нейтральном растворах.
22. Для перехода Fe3++ 3е=Fe восстановительный потенциалЕº = –0,036В. Почему же при взаимодействии металла с соляной кислотой и другими неокисляющими кислотами всегда получается только Fe2+?
23. Слиты 0,1 М прозрачные подкисленные растворы хлорида железа(III) – желто-бурый и хлорида титана(III) – фиолетовый. Полученный раствор практически бесцветный, но мутный. Напишите уравнение реакции.
24. Висмутат натрия при небольшом нагревании легко окисляет в кислой среде Мn2+ до МnО4–. Составьте уравнение этой реакции в ионной и молекулярной формах.
25. Сравните представительность плеяд галогенидов 3d-элементов. Какие факторы ее определяют? Для оксидов или галогенидов плеяды соединений более представительны? Почему? Запишите ряд высших хлоридов 3d-элементов и проанализируйте сходство и различие в их свойствах (кислотно-основных, окислительно-восстановительных, устойчивости, инертности).
26. При нагревании до 500°С твердый TiCl3диспропорционирует на ди- и тетрахлорид. Напишите уравнение реакции, укажите фазовый состав ее участников и объясните, почему реакции такого типа являются удобным (наилучшим?) способом получения низших галогенидов многих переходных металлов.
27. Парообразный тетрахлорид титана легко восстанавливается водородом до твердого трихлорида. Оцените температуру, при которой константа этого равновесия равна 1.
28. После полного испарения 0,4725 г хлорида железа(Ш) при температуре 278°С в ампуле объемом 75,0 мл установилось давление 87,69 кПа. Определите истинную формулу хлорида железа(Ш) в газовой фазе.
29. Какие свойства тетрахлорида титана делают его пригодным для создания дымовых завес?
30. Какие из нижеперечисленных соединений не могут быть получены действием галогеноводородной кислоты на металл:
1) FeBr3; 2) TiCl3; 3) ScF3; 4) CrF5; 5) MnF4
31. Какие из нижеперечисленных соединений не могут быть получены действием галогеноводородной кислоты на металл:
1) FeBr3; 2) TiCl3; 3) ScF3; 4) CrF5; 5) MnF4
32. При хранении оксохлорида ванадия(V) на воздухе в неплотно закрытом бюксе через некоторое время образуется жидкость ярко-синего цвета. Объясните причины этого явления. Как можно регенерировать исходное вещество?
33. При взаимодействии оксида марганца(II) с хлором при температуре 200ºС наряду с дихлоридом марганца образуются оксиды Mn2O3 и Mn3O4. Предложите, какой реагент следует добавить в реакционную смесь, чтобы получить безводный дихлорид марганца с практически количественным выходом.
34. Невнимательный студент, получая бром, хотел провести реакцию окисления бромида калия дихроматом калия в присутствии концентрированной серной кислоты, но перепутал банки и вместо КВг ввел в реакцию KCl. Отогнав из реакционной смеси «бром», студент пошел показывать его преподавателю, а Вы напишите правильное уравнение произошедшей реакции.
35. Как меняется ЭСПЛ ионов [М(Н2O)6]2+ в ряду Sc–Zn?
36. Приготовлен раствор, содержащий 0,10 М хлорида железа(III) – желто-бурый и 0,10 М хлорида никеля(II) – зеленый. К раствору добавлен избыток раствора аммиака. Напишите уравнения реакций, в результате которых раствор стал ярко-синим и мутным. Объясните, каким будет цвет выпавшего осадка.
37. Предложите простейший способ, позволяющий различить внешне одинаковые растворы сульфата меди и сульфата ванадила.
38. В лабораторной практике для контроля пригодности осушителя последний нередко пропитывают раствором хлорида кобальта, а затем высушивают. Объясните, почему изменение окраски такого осушителя может служить критерием его эффективности.
39. Какие лиганды будут стабилизировать степени окисления меди +1; +2; +3?
40. Какие лиганды будут стабилизировать степени окисления никеля 0, +2, +3, +4?
41. Какой ион – Ni2+(aq) или Mn2+(aq) – легче образует сульфид при насыщении водного раствора сероводородом? Для ответа на вопрос воспользуйтесь положениями теории жестких и мягких кислот и оснований.
42. Рассмотрите электронное строение дигидратовтетраацетатов хрома(II), хрома(III), меди(II). Укажите, в каком соединении кратность связи максимальна, в каком – минимальна. Как изменится кратность связи при замене воды на пиридин?
43. Какие комплексы будут образовываться при обработке высшего оксида ванадия (а) плавиковой кислотой; (б) концентрированной соляной кислотой?
44. Окисление кобальта(II) перекисью водорода в щелочной среде в насыщенном растворе гидрокарбоната натрия приводит к образованию зеленого трис-карбонатного комплекса. Изобразите структуры возможных изомеров этого соединения. Напишите уравнения реакций, протекающих при обработке этого комплекса (а) соляной кислотой; (б) разбавленной серной кислотой.
Домашнее задание
1. Закончите и уравняйте химические реакции:
Mn(OH)2 + Cl2 + KOH → CrCl3 + NaClO + NaOH→
Fe(OH)2 + Br2 + KOH → K2CrO4 + H2SO4 (конц., изб) →
Cu2O + H2O2→ MnSO4 + KCN + O2→
TiCl2 (крист) 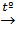 CuCl2 + KI (изб)→
CuCl2 + KI (изб)→
MnO2 + H2SO4 (конц.) → K2MnO4 + H2SO4→
Mn2(CO)10 + Br2 (ж)→ Fe(CO)5 + NaOH (р-р)→
2. Рассмотрите взаимодействие
а) нитрата серебра и аммиака;
б) хлорида железа и аммиака;
в) сульфата меди и аммиака;
г) сулемы и иодида калия;
д) хлорида никеля и цианистого калия;
е) гексааквахлом (II) иодида и пероксида водорода
в различных средах при различных условиях (при комнатной и повышенной температурах, в раствором с различным значением рН, в условиях строгой стехиометрии, при большом избытке одного из реагентов и т.п.). Представьте себе, как Вы проведете опыт в каждом случае, оцените продукты взаимодействия и напишите уравнения соответствующих реакций.
3. На столе стоят три стакана: 1) с водой, 2) с 5 М раствором щелочи и 3) с 5 М раствором соляной кислоты. В каждый стакан всыпали небольшое количество безводного трихлорида железа и тщательно перемешали. Опишите происходящие при этом процессы. Укажите, какие процессы будут происходить при растворении вещества, если FeCl3 заменить на CrCl3, VOCl3, FeCl2, CrО3, CuCl2, ZnCl2, MnО2.
4. Опишите процессы и напишите уравнения реакций, с помощью которых можно получить из Сr2О3 следующие продукты: а) К2Сr2O7; б) K3[Cr(CN)6]; в) [Cr(NH3)6]Cl3; г) К2СrO4; д) СrO3?
 2018-03-09
2018-03-09 157
157








