Второе начало термодинамики (второй закон термодинамики) устанавливает существование энтропии как функции состояния термодинамической системы и вводит понятие абсолютной термодинамической температуры, то есть «второе начало представляет собой закон об энтропии» и её свойствах. В изолированной системе энтропия остаётся либо неизменной, либо возрастает (в неравновесных процессах), достигая максимума при установлении термодинамического равновесия (закон возрастания энтропии). Встречающиеся в литературе различные формулировки второго начала термодинамики являются частными следствиями закона возрастания энтропии.
Изменение энтропии однозначно определяет направление и предел самопроизвольного протекания процесса лишь для наиболее простых систем – изолированных. В изолированных системах самопроизвольно идут процессы, при которых происходит увеличение энтропии, или всякая изолированная система самопроизвольно стремиться принять состояние, характеризующееся максимальной термодинамической вероятностью. На основании уравнения Больцмана любой необратимый процесс, самопроизвольно протекающий в изолированной системе, характеризуется увеличением энтропии.Другими словами, процессы протекают самопроизвольно лишь в сторону менее упорядоченного состояния, т.е. нарастания беспорядка. Именно поэтому испарение жидкости, растворение соли в воде или смешение газов происходит самопроизвольно, а вместе с тем обратные процессы без обмена энергией с окружающей средой невозможны. Следовательно, увеличение энтропии является критерием самопроизвольного протекания процессов только в изолированных системах, т.е. не обменивающихся энергией с внешней средой, а это довольно редкий случай. В открытых и замкнутых системах, кроме изменения энтропии, на направление процесса влияет еще и изменение энтальпии.
ЭНТРОПИЯ - функция состояния термодинамической системы, изменение которой dS в равновесном процессе равно отношению количества теплоты dQ, сообщенного системе или отведенного от нее, к термодинамической температуре Т системы, т.е. мера беспорядка (и характеристика состояния). Физический смысл этот состоит в том, что изменение энтропии является мерой необратимости процессов в замкнутой системе и характеризует направление естественных процессов в такой системе.
Свободная энергия или Энергия Гиббса G – это та часть всей энергии системы, которую можно использовать для совершения максимальной работы. Это математическая величина, равная изменению внутренней энергии системы в ходе химической реакции; показывающая, какая часть от полной внутренней энергии системы может быть использована для химических превращений или получена в их результате в заданных условиях; и позволяющая установить принципиальную возможность протекания химической реакции в заданных условиях.
Энергия Гельмгольца A — это та часть внутренней энергии системы, также определяющая работоспособность и может быть применена для совершения максимальной работы. Термодинамический потенциал, убыль которого в квазистатическом изотермическом процессе равна работе, совершённой системой над внешними телами.
18. Скорость химической реакции. Закон действующих масс. Молекулярность и порядок реакции.
Ско́ростьхими́ческойреа́кции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1. Изучение различных кинетических кривых показывает, что скорость уменьшения концентрации реагента со временем падает. Наблюдаемое падение скорости, очевидно, связано с уменьшением концентрации реагентов. Кинетические исследования подтверждают правильность этого предположения, выражаемого в наиболее общем виде с помощью закона действующих масс для скорости реакции.
Зако́нде́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ.
Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
В химической термодинамике закон действующих масс связывает между собой равновесные активности исходных веществ и продуктов реакции.
Молекулярность реакции – это минимальное число молекул, участвующих в элементарном химическом процессе. По молекулярности элементарные химические реакции делятся на молекулярные (А →) и бимолекулярные (А + В →); тримолекулярные реакции встречаются чрезвычайно редко.
Порядок реакции: общий порядок, реакция нулевого порядка, реакция 1 порядка, реакция 2 порядка, реакция третьего порядка.
Влияние температуры на скорость реакции. Понятие температурного коэф-фициента и уравнение Вант-Гоффа. Уравнение Аррениуса. Энергия актива-ции. Влияние давления на скорость реакции.
Правило Вант-Гоффа - при повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два—четыре раза.
Уравнение, которое описывает это правило, следующее  где V2 {\displaystyle V_{2}} — скорость реакции при температуре {\displaystyle T_{2}}T2, V1{\displaystyle V_{1}} — скорость реакции при температуре {\displaystyle T_{1}}T1 {\displaystyle \gamma },у — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов). Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400 oC. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например, белки в биологических системах.
где V2 {\displaystyle V_{2}} — скорость реакции при температуре {\displaystyle T_{2}}T2, V1{\displaystyle V_{1}} — скорость реакции при температуре {\displaystyle T_{1}}T1 {\displaystyle \gamma },у — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов). Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400 oC. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например, белки в биологических системах.
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле: 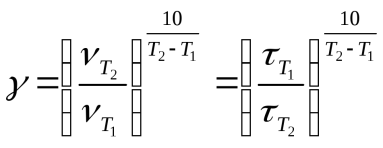 (первая часть форм)
(первая часть форм)
Уравне́ниеАрре́ниуса устанавливает зависимость константы скорости {\displaystyle k}К химической реакции от температуры {\displaystyle T}Т.

Раскалённая стружка стали, образующаяся от трения о кремень, обеспечивает энергию активации для зажигания газовой горелки. Теперь пламя не погаснет, так как реакция экзотермическая.
Энергия активации — минимальное количество энергии, которое требуется сообщить системе (выражается в джоулях на моль), чтобы произошла реакция.
Давление сильно влияет на скорость реакций с участием газов, потому что оно непосредственно определяет их концентрации.
В уравнении Менделеева-Клапейрона:
pV = nRT
перенесем V в правую часть,, а RT - в левую и учтем, что n/V = c:
p/RT = c
Давление и молярная концентрация газа связаны прямо пропорционально. Поэтому в закон действующих масс мы можем подставлять вместо концентрации p/RT.
20. Химическое равновесие. Обратимые и необратимые химические процессы. Константа химического равновесия. Смещение химического равновесия со- гласно принципу Ле-Шателье.
Химическое равновесие — состояние химической системы, в которой протекает одна или несколько химических реакций, причём скорости в каждой паре прямой-обратной реакции равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях. уравнениях обратимых реакций между левой и правой частями ставят две стрелки, направленные в противоположные стороны. Необратимыми называются такие реакции, при протекании которых: образующиеся продукты уходят из сферы реакции — выпадают в виде осадка, выделяются в виде газа, образуется малодиссоциированное соединение, например вода.реакция сопровождается большим выделением энергии, например горение магния. В уравнениях необратимых реакций между левой и правой частями ставится знак равенства или стрелка.
Константа химического равновесия — характеристика химической реакции, по значению которой можно судить о направлении процесса при исходном соотношении концентраций реагирующих веществ, о максимально возможном выходе продукта реакции при тех или иных условиях. Константа химического равновесия определяется по закону действующих масс. Ее значения находят расчетно или на основании экспериментальных данных. Константа химического равновесия зависит от природы реагентов и от температуры.
K=k1/k−1, где k1 — константа скорости прямой реакции, k−1 — константа скорости обратной реакции.
Смещение химического равновесия Принцип работы: если на систему воздействовать, то она противодействует. Факторы, влияющие на химическое равновесие: температура (При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении — в сторону экзотермической (выделение) реакции), давление, (При повышении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении — в сторону большего объёма.Этот принцип действует только на газы, то есть если в реакции участвуют твёрдые вещества, то они в расчёт не берутся), концентрация исходных веществ и продуктов реакции (При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при понижении концентрации — в сторону исходных веществ). Катализаторы не влияют на смещение химического равновесия.
 2018-02-13
2018-02-13 2248
2248
