Итак, далее рассматривается физическая модель газа, согласно которой:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда считаются абсолютно упругими.
Исходя из этого, идеальный газ можно рассматривать как совокупность беспорядочно движущихся молекул-шариков, имеющих пренебрежимо малый собственный объем и не взаимодействующих друг с другом на расстоянии.
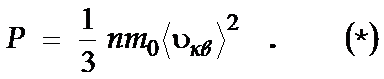
Это уравнение наз-ся уравнение МКТ (для давления), где масса молекулы-m 0 , движущихся со скоростью v. n = N/ V, где N- число молекул.
3. термодинамическая температура — есть мера средней кинетической энергии поступательного движения молекул газа, в этом ¾ молекулярно-кинетическое толкование температуры.
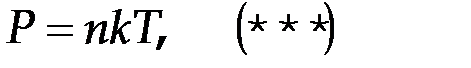 . Это ур-ние связывает давление постоянной массы газа с термодинамической температурой. (Р - есть давление постоянной массы,
. Это ур-ние связывает давление постоянной массы газа с термодинамической температурой. (Р - есть давление постоянной массы, 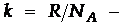 постоянная Больцмана (k = 1.38×10-23 Дж/К,
постоянная Больцмана (k = 1.38×10-23 Дж/К, 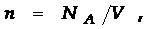 где Na- числo Авогадро.) Это уравнение является еще одной из формулировок основного уравнения МКТ.
где Na- числo Авогадро.) Это уравнение является еще одной из формулировок основного уравнения МКТ.
Вопрос №9.
 2018-02-14
2018-02-14 252
252








