 Ток в жидкостях
Ток в жидкостях
Вещества, в которых при прохождении тока происходят химические превращения, называют электролитами (подобные среды ещё именуют проводниками 2-го рода). К их числу относятся растворы солей или щелочей в воде и нек-рых других жидкостях, а также расплавы солей, являющиеся в твёрдом состоянии ионными кристаллами.
Электропроводимость у электролитов существует за счет ионов (заряженных атомов или частей молекул – т.н. радикалов), которые появляются в растворе благодаря распаду на части молекул растворенного вещества под действием молекул растворителя. В воде, например, обладающей большой диэлектрической проницаемостью, ослабляются электрические связи между атомами растворённых молекул. При распаде молекулы на два иона, каждый из них приобретает избыточный ЭЗ за счет захвата электрона одним из атомов (отрицательный ион) и потери его другим. Распад молекулы в растворе носит название диссоциации, диссоциирует только часть молекул, поэтому вводится коэффициент a, определяющий эту часть по отношению к общему числу молекул. Заряды, приобретённые в рез-те диссоциации, меняют химические свойства ионов (по сравнению с атомами) и делают их химически неактивными относительно молекул воды.
 Ионы в отсутствие электрического поля (ЭП) движутся хаотично, и ток при этом не возникает. Под действием ЭП ионы приходят в упорядоченное движение, которое накладывается на хаотическое. При этом происходит направленный перенос заряда ионов. Ионы оказываются окружёнными так называемыми сольватными оболочками из молекул растворителя. Их движение поэтому можно рассматривать как перемещение шариков в вязкой среде. При движении таких частиц сила сопротивления пропорциональна скорости
Ионы в отсутствие электрического поля (ЭП) движутся хаотично, и ток при этом не возникает. Под действием ЭП ионы приходят в упорядоченное движение, которое накладывается на хаотическое. При этом происходит направленный перенос заряда ионов. Ионы оказываются окружёнными так называемыми сольватными оболочками из молекул растворителя. Их движение поэтому можно рассматривать как перемещение шариков в вязкой среде. При движении таких частиц сила сопротивления пропорциональна скорости 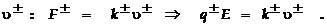 Здесь знаки ± соответствуют знаку зарядов ионов; соответственно различными будут и направления скоростей в ЭП с напряжённостью E,
Здесь знаки ± соответствуют знаку зарядов ионов; соответственно различными будут и направления скоростей в ЭП с напряжённостью E,  коэффициент трения иона при движении. Ион движутся с ускорением под действием ЭП E, пока кулоновская сила не станет уравновешенной силой трения. Величина
коэффициент трения иона при движении. Ион движутся с ускорением под действием ЭП E, пока кулоновская сила не станет уравновешенной силой трения. Величина  определяет скорость ионов при напряжённости ЭП в 1 В / м, т.е.
определяет скорость ионов при напряжённости ЭП в 1 В / м, т.е.  носят название коэффициентов подвижности (их величины м-т быть различными у ионов противоположных знаков).
носят название коэффициентов подвижности (их величины м-т быть различными у ионов противоположных знаков).
 Плотность тока в растворе по определению
Плотность тока в растворе по определению 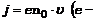 ЭЗ электрона,
ЭЗ электрона,  число ионов /концентрация/ в ед-це объёма), т.е., с учётом различия знаков заряда у ионов и их валентности
число ионов /концентрация/ в ед-це объёма), т.е., с учётом различия знаков заряда у ионов и их валентности 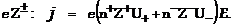 В случае одинаковой валентности закон Ома для электролитов формулируется так:
В случае одинаковой валентности закон Ома для электролитов формулируется так: 
 (a - коэффициент диссоциации). С повышением температуры значения удельной проводимости электролитов
(a - коэффициент диссоциации). С повышением температуры значения удельной проводимости электролитов  возрастают из-за увеличения
возрастают из-за увеличения  и
и 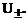
Ø Итак, если в электролит ввести электроды, то катионы движутся к катоду, а отрицат. ионы (анионы) – к аноду. При утрате заряда на поверхности электродов ионы превращаются в нейтральные атомы или радикалы. Эти частицы не могут существовать в растворе без заряда и вступают в химические реакции с растворителем или веществом электродов. Вблизи электродов происходит выделение новых веществ, которые отсутствовали в растворе. Этот процесс выделения веществ на электродах при прохождении через электролит электрич. тока называется электролизом. Количественно электролиз характеризуется законом Фарадея: выделившаяся на электроде масса m = k × q. Здесь k — электрохимич. эквивалент; переменный ЭЗ q (t) чаще выражается ч/з силу тока i: d q = i (t) d t. Тогда m = k ×  масса вещества (металла), выделившегося на катоде за время t. Величину k выражают также т.о.
масса вещества (металла), выделившегося на катоде за время t. Величину k выражают также т.о. 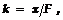 где X = A/Z – химичecкий эквивалент, А — атомная масса, Ζ — валентность; F — число Фарадея.
где X = A/Z – химичecкий эквивалент, А — атомная масса, Ζ — валентность; F — число Фарадея.
 2018-02-14
2018-02-14 326
326








