При изотермическом процессе изменения внутренней энергии в идеальном газе не происходит и все подводимое к газу количество теплоты идет на совершение им работы. T = const, U = const, ΔU = 0, Q = A.
При изохорном процессе объем газа остается постоянным. Соответственно, не совершается работа и внутренняя энергия газа изменяется исключительно за счет теплообмена с окружающей средой V = const, ΔV = 0, A = 0, ΔU = QV (Индекс V означает, что процесс протекает при постоянном объеме).
Если при теплообмене происходит изменение температуры газа на ΔT, то QV = CVmΔT. CV – удельная теплоемкость газа при постоянном объеме.
Подставляя это выражение в уравнение первого закона термодинамики для изохорного процесса, имеем: ΔU = CVmΔT. С другой стороны, для одноатомного идеального газа  . Приравняв правые части уравнений и произведя соответствующие преобразования, имеем:
. Приравняв правые части уравнений и произведя соответствующие преобразования, имеем: 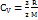
При изобарном процессе изменение внутренней энергии газа происходит как за счет теплообмена, так и за счет совершения механической работы. Если к газу подводится некоторое количество теплоты, то оно частично расходуется на увеличение внутренней энергии газа, частично на совершение газом работы при его расширении. p = const, A = pΔV, Qp = ΔU + pΔV.(Индекс p означает, что процесс протекает при постоянном давлении). Давление газа остается постоянным за счет соответствующего изменения объема. Так как ΔU = QV, то Qp = QV + pΔV. Таким образом оказывается, что для повышения температуры газа на одно и то же количество градусов при постоянном давлении надо сообщить ему большее количество теплоты, чем при постоянном объеме, так часть теплоты расходуется на совершение работы.
Адиабатический процесс.работа совершается газом только за счет внутренней энергии:Q = ∆U + A = 0; A = –∆U. Здесь: Q — количество теплоты, полученной газом; ∆U — приращение (изменение) внутренней энергии; A — работа, совершенная телом при расширении.
Таким образом, работа A, совершенная газом при расширении, равна убыли внутренней энергии –∆U. Положительная работа при адиабатическом процессе практически всегда (за исключением редких случаев) происходит с уменьшением температуры. Для идеального газа внутренняя энергия может быть вычислена по формуле: U = i/2 νRT, Здесь: i — число степеней свободы 1 молекулы газа; ν — количество вещества газа; R — универсальная газовая постоянная, T — абсолютная температура по шкале Кельвина. Подставив это выражение в формулу, выражающую первое начало термодинамики для адиабатического процесса, получим: A = i/2 νR(T1 –T2).
 2018-02-14
2018-02-14 267
267







