Аналитическое выражение I закона т/д-ки.
Если к 1кг рабочего тела подвести некоторое элементарное количество теплоты dQ, то его температура изменится на величину dT, а внутренняя энергия на dU. При изменении температуры, объем увеличится на величину dV, а с увеличением объема увеличивается его потенциальная энергия и будет совершена внешняя работа расширения dL. И если в рабочем теле не происходит каких-либо других явлений и отсутствует кинетическая энергия видимого движения, то согласно закону сохранения энергии можно записать:
dq=dU+dl; q=ΔU+l; ΔU=q-l; U2-U1=q-l. (23)
Энергия, подведенная в форме теплоты к рабочему телу расходуется на изменение внутренней энергии ΔU и на совершение работы расширения (l).
Внутренняя энергия.
Внутренняя энергия включает в себя:
1 кинетическую энергию поступательного, вращательного и колебательного движения частиц.
2 потенциальную энергию взаимодействия частиц.
3 энергию электронных оболочек.
4 внутриядерную энергию.
Т.к. в большинстве случаев 3 и 4 являются постоянными, то в дальнейшем под внутренней энергией будем понимать энергию хаотического движения молекул и атомов. Для реальных газов необходимо учитывать потенциальную энергию. Поэтому внутренняя энергия есть некоторая однозначная функция состояния тела, т.е. любых двух независимых параметров.
U=f(P,T); U=f(υ,P); U= f(υ,T).
Изменение внутренней энергии не зависит от характера процесса, а определяет только начальное и конечное состояние тела.
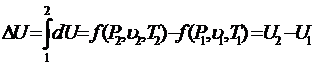 (24)
(24)
Внутренняя энергия идеального газа, в которой отсутствуют силы межмолекулярного взаимодействия не зависит от V тела или Р, а определяется только конечной температурой
ΔU=f(T). (25)
А для реального это нужно учитывать. Для идеального газа 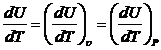

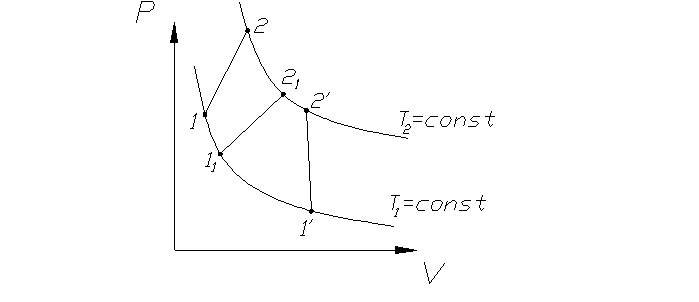 Рис. 3 ΔU=U2-U1= U2-U1= U2’-U1’
Рис. 3 ΔU=U2-U1= U2-U1= U2’-U1’
ΔU=f(T2)-f(T1)
Работа газа. Рабочая диаграмма P-V. Работа расширения и полезная работа газа.
Передача энергии от одного тела к другому, связанная с изменением объема рабочего тела, с перемещением его во внешнем пространстве или с изменением его положения называется работой. В этом процессе участвуют два или более тел. 1-ое тело, производящее работу – отдает энергию; 2– ое тело получает энергию. Совершенная газом работа зависит от p, V, T.
Рассмотрим частный случай: работа расширения 1кг газа в равновесном процессе при постоянном давлении. Давление рабочего тела равно давлению окружающей среды.
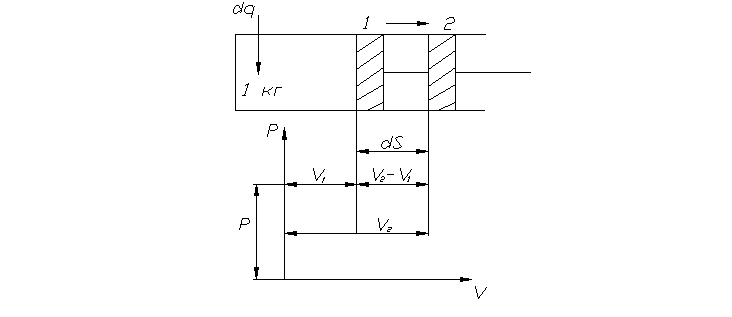 Рис. 4
Рис. 4
Pdf – сила, действующая на поршень
Работа dl=p·df·dS (1).
Работа l, совершаемая системой при конечном изменении объема от V1 до V2 в произвольном равновесном процессе. 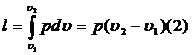
В реальном произвольном процессе р≠const и изменяется с
изменением удельного объема υ. p=f(υ)

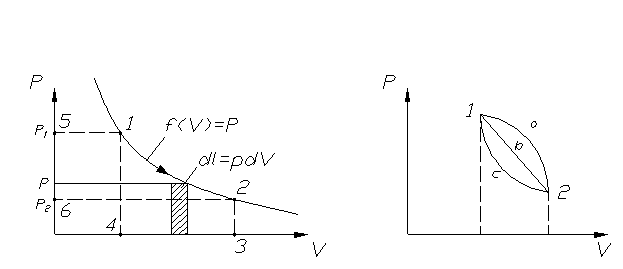
Из рисунка видно, что S1,2,3,4 под процессом 1, 2 = работе расширения l, что следует из уравнения 3. Графическое представление процесса в координатах p-υ называется рабочей диаграммой.
Если процесс осуществляется в направлении 1→2, это работа расширения, она положительна, т.к. dυ>0, совершается самой системой и оценивается площадью под линией процесса 1234.
1®2 dv>0 “+ l ” (1234).
Если наоборот, процесс протекает в направлении 2®1, то dυ<0, работа отрицательна (работа сжатия), затрачивается извне и оценивается площадью под линией процесса 4321.
2®1 dv<0 “-l ” (4321).
Работа в отличие от изменения внутренней энергии зависит от характера процесса. Рассмотрим 3 процесса совершения работы а,в и с. Они начинаются состоянием 1(р1,v1,т1) и заканчиваются состоянием 2 (р2,v2,т2), но промежуточные состояния различны. Изменение внутренней энергии для всех 3 процессов одинаково
ΔU = ΔUA= ΔUВ= ΔUС,
А работа различна
LА> LВ> LС.
Встречаются случаи, когда в рабочем теле изменяется внешняя кинетическая энергия без изменения объема (например, перемешиание мешалками). В таком процессе
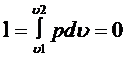 , т.к.
, т.к. 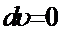 ()
()

Работу внешнего источника обозначим 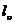 , следовательно работа системы складывается в общем случае из работы расширения и работы, совершаемой без изменения объема:
, следовательно работа системы складывается в общем случае из работы расширения и работы, совершаемой без изменения объема:

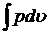 . ()
. ()
Полезная (располагаемая) работа. При расширении газа не вся работа может быть полезно использована. Часть этой работы тратится на вытеснение среды, давление которой изменяется от р1 до р2..
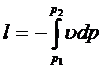 ()
()
 2018-02-14
2018-02-14 301
301








