С одним гетероатомом
Эти соединения отвечают общей формуле:
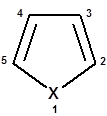
Фуран, пиррол и тиофен
К простейшим ароматическим пятичленным гетероциклическим соединениям с одним гетероатомом относятся фуран, пиррол и тиофен.

X = O (фуран) X = N−H (пиррол) X = S (тиофен)
Способы получения
Фуран, пиррол и тиофен представляют собой бесцветные, легкокипящие жидкости, встречающиеcя в каменноугольной смоле, откуда могут быть выделены (за исключением фурана). В практике химика-органика их обычно получают реакцией циклизации соответствующих 1,4-дикарбонильных соединений путем нагревания их либо с серной кислотой (для получения фурана), либо с аммиаком (для получения пиррола), либо с сульфидом фосфора (для получения тиофена):

Кроме того, по реакции Ю. К. Юрьева фуран, пиррол и тиофен могут переходить друг в друга при нагревании до 450 °С над оксидом алюминия (III). Реакция идет по схеме:

Строение
По типу связей и химическому поведению эту группу пятичленных гетероциклических соединений следует отнести к ароматическим системам. Их ароматический характер, как и у бензола, определяется прежде всего наличием кольцевого секстета р -электронов. При этом все атомы гетероциклической системы (4 атома углерода и гетероатом) находятся в состоянии sp 2-гибридизации. Гибридизованные орбитали при аксиальном перекрывании формируют плоский σ-скелет молекулы, а негибридизованные 2 рz -орбитали, ориентированные перпендикулярно плоскости цикла, перекрываясь латерально, образуют ароматический секстет:

 |
 |
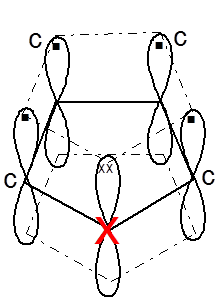

Аналогично бензолу фуран, пиррол и тиофен подчиняются правилу ароматичности Хюккеля при n = 1.
Электронные смещения в молекулах пятичленных гетероциклов обусловлены двумя противоположными по направлению эффектами: положительным мезомерным эффектом (p,π-сопряжение) и отрицательным индукционным, направленным из кольца к гетероатому. За счет преобладающего
+ М- эффекта четыре атома углерода кольца имеют большую электронную плотность, чем атомы углерода бензола. Такое направление электронных смещений подтверждается и расчетами эффективных зарядов методом молекулярных орбиталей (на примере молекулы пиррола):

Это указывает на то, что пятичленные гетероароматические соединения являются электроноизбыточными системами: шесть р -электронов в их молекулах делокализованы между пятью атомами цикла. Ароматический характер фурана, пиррола и тиофена подтверждает и теория резонанса. Структура всех пятичленных гетероциклических соединений – динамическое образование, которое можно представить в виде набора предельных резонансных структур. Наложением предельных резонансных структур друг на друга получаем мезоструктуру, которая обычно характеризует распределение электронной плотности в молекуле.

- I -эффект << + М -эффекта

мезоструктура
Исходя из электронного строения и мезоструктур пятичленных гетероциклов можно сделать следующие выводы:
1. Молекула плоская, что определяется sp 2-гибридизацией всех атомов цикла.
2. Электронная плотность в молекуле распределена неравномерно и смещена в сторону атомов углерода цикла. Это подтверждается расчетом эффективных зарядов на атомах методом МО.
3. Неравномерность распределения электронной плотности, в отличие от бензола, определяет полярный характер молекул рассматриваемых гетероциклических соединений. При этом на величины и направленность дипольных моментов оказывает влияние не только электроотрицательность гетероатомов, но и характер электронных смещений в молекуле. Это хорошо видно из сравнения дипольных моментов фурана, пиррола и тиофена с таковыми у их полностью восстановленных аналогов. Если на величину и направление дипольных моментов последних оказывает влияние только отрицательный индуктивный эффект (– I) гетероатомов, то у первых – значительное снижение дипольного момента обусловлено противоположным по направлению и значительным по величине + М -эффектом. Ниже приведены наблюдаемые дипольные моменты у восстановленных и невосстановленных пятичленных гетероциклов.

тетрагидрофуран тетрагидропиррол тетрагидротиофен
μ =1,68 D μ = 1,57 D μ= 0,52 D

фуран пиррол тиофен
μ = 0,71 D μ = 1,8 D μ= 1,87 D
– I > + M – I < + M
4. Одним из основных признаков ароматических соединений является выравненность всех связей в цикле. В пятичленных гетероциклах они не могут быть выравненными, поскольку длины связей С−С и С−Х неравнозначны. Следовательно, структуры фурана, пиррола и тиофена представляют собой неправильные пятиугольники.

фуран пиррол

тиофен
5. Циклическая делокализация р -электронов кольца и их количественное соответствие правилу Хюккеля (при n = 1) указывает на то, что рассматриваемые гетероциклические соединения являются ароматическими системами. Об этом свидетельствуют их величины энергии сопряжения. Они меньше, чем у бензола (150 кДж/моль), и их значения уменьшаются в ряду тиофен (120 кДж/моль), пиррол (110 кДж/моль), фуран (90 кДж/моль). Это связано с различием в электроотрицательностях гетероатомов, входящих в состав циклов. Естественно, что в этой же последовательности уменьшается и ароматический характер этих соединений.
6. Поскольку пятичленные гетероароматические соединения являются
π-избыточными, для них должно быть характерно облегченное (по сравнению с бензолом) протекание SE - и А -реакций. При этом электрофильная атака ориентирована на Сα-замещение, активность которой уменьшается в ряду фуран – пиррол – тиофен. А -процессы, приводящие к разрушению ароматического π -электронного секстета (например, гидрирование), должны протекать для этих соединений в более мягких, чем для бензола, условиях.
 2020-01-15
2020-01-15 1026
1026








