Общим или суммарным порядком реакции называют сумму всех показателей степеней при концентрациях в выражении закона действующих масс, установленным опытным путем:
n = a + b + c …,
где a, b, с - частные порядки реакции, соответственно по веществам A, B и C.
Наиболее просты следующие случаи:
1) реакции нулевого порядка: 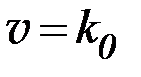 , n = 0;
, n = 0;
2) реакции первого порядка: 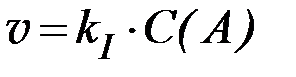 , n = 1;
, n = 1;
| n = 2; |
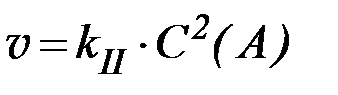 ,
,

| n = 3. |
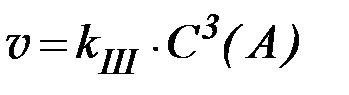 ,
,
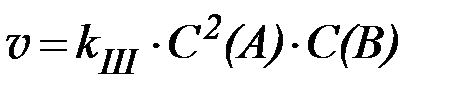 ,
,
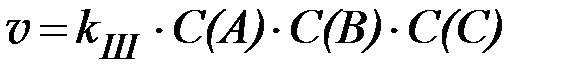
Молекулярность реакции.
Молекулярность реакции - число молекул, участвующих в элементарном акте реакции.
Следует отметить, что понятие молекулярности можно применять только для элементарных реакций. К числу элементарных реакций относится, например, разложение 1,2-диметилдиазена:
CH3N = NCH3 C2H6 + N2.
Данная реакция является мономолекулярной - в элементарном акте участвует одна молекула. Если в одном акте в реакцию вступают две молекулы, то реакция является бимолекулярной.
Период полупревращения реакции первого порядка.
Реакции I порядка.
Живой организм рассматривается как реакции перового порядка, т.е. концентрация каждого вещ-ва уменьшается независимо от другого.
Для реакций I порядка убыль концентрации реагента определяется уравнением:

|
где С – концентрация вещества в данный момент времени;
С0 – начальная концентрация вещества;
kI – константа скорости реакции первого порядка;
t – время.
В логарифмической форме это выражение выглядит так:

|
Из приведенных формул можно сделать ряд важных заключений:
1) константа скорости реакции первого порядка имеет размерность [время-1] и может быть выражена в обратных секундах, минутах, часах и т. д.;
2) величина kI не зависит от способа выражения концентрации реагента;
3) в реакциях первого порядка одинаковым промежуткам времени отвечают одинаковые доли прореагировавшего вещества.
Периодом полупревращения (t1/2) называют время, необходимое для превращения половины первоначального количества вещества.
Таким образом, в момент времени t = t1/2 количество непрореагировавшего вещества составляет  С0. В этом случае:
С0. В этом случае:
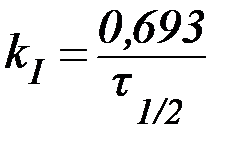 . .
|
Из данной формулы следует, что в реакциях первого порядка период полупревращения не зависит от начальной концентрации реагента.
В некоторых случаях удобно использовать формулу:
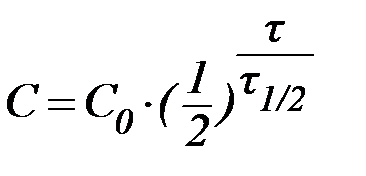 , ,
|
которая позволяет определить время, за которое превращению подвергнется определенное количество исходного вещества.
В организме человека процессы метаболизма лекарственных препаратов протекают, в основном, в соответствии с уравнением реакции первого порядка. Период, за который превращению подвергается половина действующего начала препарата называется периодом полувыведения или полуэлиминации.
Период полувыведения - промежуток времени, за которое из организма выводится 50% вещ-ва.
Зная величины kI и t1/2, можно рассчитать оптимальные промежутки времени между приемами лекарственного средства.
 2020-01-15
2020-01-15 136
136








