Вопросы к экзамену по химии
1. Термодинамическая система, типы термодинамических систем. термодинамические процессы. Процессы экзотермические и эндотермические.
Термодинамическая система - это часть макроскопического пространства, ограниченная реальной или воображаемой поверхностью от окружающей среды.
По типу взаимодействия системы с окружающей средой различают:
открытые системы - возможен теплообмен и обмен массой;
закрытые системы - возможен теплообмен, но нет обмена массой;
изолированные системы - невозможен теплообмен и обмен массой.
Строго говоря, изолированных систем в природе не существует. Примером открытой системы может служить любой живой организм.
Термодинамический процесс связан с изменением хотя бы одного термодинамического параметра. Постоянство определенного параметра в ходе процесса отмечают приставкой изо-:
изохорный процесс - при постоянном объеме;
изобарный процесс - при постоянном давлении;
изотермический процесс - при постоянной температуре.
В экзотермическом процессе теплота освобождается в окружающую среду (Q > 0)
В экзотермическом процессе теплота освобождается в окружающую среду (Q > 0)
Энтальпия. Первый закон термодинамики.
Энтальпия ( H) - термодинамическая функция состояния системы энтальпия характеризует теплосодержание системы
В экзотермическом процессе теплота освобождается в окружающую среду (Q > 0), при этом изменение энтальпии DН считается отрицательным.
В эндотермическом процессе теплота поглощается (Q < 0), а значение DН - положительно.
I закон термодинамики:
Изменение внутренней энергии системы DU равно сумме количества теплоты Q, переданного системе, и работы А, совершенной окружающей средой над системой:
| DU = Q + A, | (1) |
I закон термодинамики позволяет рассчитывать тепловые эффекты различных процессов, но не дает информацию о направлении протекания процесса
Закон Гесса и следствия из него, стандартная энтальпия образования (сгорания) веществ.
Закон Гесса:
Изменение энтальпии реакции образования заданных продуктов из данных реагентов не зависит от числа и вида реакций, в результате которых образуются эти продукты.
I следствие:
Изменение энтальпии реакции равно сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ с учетом стехиометрических коэффициентов. 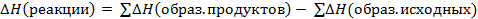
II следствие:
Изменение энтальпии реакции равно сумме стандартных энтальпий сгорания исходных веществ за вычетом суммы стандартных энтальпий сгорания продуктов реакции с учетом стехиометрических коэффициентов.
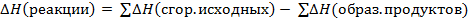
Величину теплового эффекта реакции, измеренную при стандартных условиях и взятую с обратным знаком, называют стандартной энтальпией реакции и обозначают DН0.
 2020-01-15
2020-01-15 148
148







