1. Определение активной реакции воды (pH)
Определение активной реакции воды (pH) может проводиться потенциометрическим методом – наливают в стаканчик воду и проводят измерение pH по шкале потенциометра. Также может использоваться колориметрическое определение – к исследуемой воде добавляют основной индикатор и сравнивают интенсивность окрашивания со шкалой pH. Приблизительную концентрацию ионов водорода можно установить по готовым индикаторным бумажкам.
2. Определение содержания общего железа
Фотометрический метод с сульфосалицилатом натрия – сульфосалициловая кислота или ее натриевая соль образует с солями железа окрашенные комплексные соединения. Причем в слабо кислой среде она реагирует только с солями Fe(III) – красное окрашивание; а в слабо щелочной – с солями Fe(III) и Fe(II) – желтое окрашивание.
3. Определение содержания марганца
Фотометрический метод основан на количественном окислении ионов марганца (II) до перманганат-ионов в азотнокислой среде действием персульфата аммония в присутствии катализатора – ионов серебра.
4. Определение общей жесткости
Пипеткой отмеряют 100 мл исследуемой воды в коническую колбу, добавляют буферный раствор и индикатор и титруют раствором трилона Б. Определение повторяют и берут средний результат. Вычисление общей жесткости в мг · экв/дм³ производят по формуле:
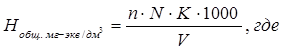
n – количество трилона Б, израсходованное на титрование, в мл;
K – поправочный коэффициент к нормальности трилона Б;
V – объем пробы, в мл;
N – нормальность трилона Б.
5. Определение содержания хлоридов
Определение хлоридов ведется по методу Мора.
Принцип метода Мора основан на осаждении хлоридов азотнокислым серебром в присутствии хромата калия K2CrO4. При наличии в растворе хлоридов AgNO3 связывается с ними, а затем образует хромат серебра оранжево-красного цвета.
Устанавливается титр AgNO3 : в коническую колбу на 200 мл вносят 10 мл раствора NaCl и 90 мл дистиллированной воды, прибавляют 5 капель K2CrO4 . Содержимое колбы титруют раствором AgNO3 до перехода лимонно-желтой окраски мутного раствора в оранжево-красную, не исчезающую в течение 15-20 сек.
Поправочный коэффициент к титру AgNO3 рассчитывают по результатам трех титрований:
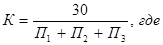
П1, П2, П3 - объем в мл AgNO3 , использованный на каждое из трех титрований.
При содержании хлоридов менее 250 мг/дм³ берут 100 мл фильтрованной исследуемой воды. При большем содержании берут 10-50 мл. Исследуемую воду наливают в две конические колбы, доводят до 100 мл дистиллированной водой, прибавляют 5 капель раствора K2CrO4 . Раствор в одной колбе титруют AgNO3 , а вторая колба используется для контроля.
Содержание хлор-иона в воде рассчитывается по формуле:

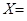
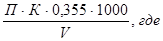
Х – содержание хлор-иона в мг/дм³;
П – количество раствора AgNO3, истраченное на титрование, мл;
К – поправочный коэффициент к титру;
0,355 – эквивалентное количество хлора, соответствующее 1 мл раствора AgNO3 , мг;
V – объем исследуемой пробы, мл.
6. Определение содержания аммония
К 100 мл испытуемой пробы воды добавляют 0,2 мл раствора сегнетововй соли и 0,2 мл реактива Несслера, перемешивают и через 10 мин измеряют оптическую плотность раствора при 425 нм в кювете толщиной 1см на фоне дистиллированной воды. Из полученного значения оптической плотности вычисляют оптическую плотность контрольной пробы. Концентрацию ионов аммония в пробе определяют по калибровочному графику.
Построение калибровочного графика: в мерные колбы на 50 мл наливают 0, 1, 2, 3, 4, 6 и 10 мл стандартного раствора NH4Cl концентрации 5 мкг NH4+ в 1 мл. Разбавляют до метки безаммиачной водой, перемешивают, отбирают из каждой колбы по 10 мл и переносят в пробирки. Концентрация ионов аммония в растворах составляет 0; 0,1; 0,2; 0,3; 0,6; 1 мг/дм³. Определение ионов аммония ведут по методике, представленной выше. Из полученных значений оптических плотностей вычисляют оптическую плотность контрольного (холостого) раствора.
Определение аммиачного азота: проводят с реактивом Несслера, предварительно обрабатывая исследуемую пробу воды десятикратным количеством 1н раствора KCl. Раствор фильтруют через платный складчатый фильтр.
Дальнейший анализ проводят согласно представленной выше методики.
7. Методика определения нитратов
Для анализа отбирают 100 мл воды или фильтрата, добавляют раствор Ag2SO4 в количестве, эквивалентном содержанию хлор-иона в пробе. Выпаривают в фарфоровой чашке на кипящей водяной бане досуха. После охлаждения сухого остатка добавляют в чашку 1 мл фенолдисульфокислоты и сразу же растирают стеклянной палочкой до полного смешения с сухим остатком. Добавляют 15-20 мл дистиллированной воды и через 10-15 мин – 5 мл концентрированного аммиака до максимального развития окраски. Раствор переносят в мерную колбу на 100 мл, ополаскивают чашку небольшим количеством дистиллированной воды и сливают их в колбу, доводя до метки 100 мл дистиллированной водой.
Оптическую плотность определяют на ФЭКе с синим светофильтром (480нм) в кюветах толщиной 2 см по отношению к дистиллированной воде с добавлением всех реактивов.
Содержание нитратов определяют по калибровочному графику.
Построение калибровочного графика: готовят стандартный раствор нитрата калия KNO3: 0,2; 0,5; 1,0; 2,0 мл. Выпаривают в фарфоровых чашках и продолжают, как при анализе пробы.
Получают шкалу растворов с содержанием 0,02; 0,05; 0,10; 0,15; 0,20 мг азота нитратов.
Фотометрируют и строят калибровочный график в координатах: оптическая плотность – содержание азота нитратов (мг).
Содержание нитратов (мг/дм³) рассчитывают по формуле:
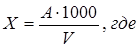
А – количество азота нитратов, найденное по калибровочному графику или по шкале стандартных растворов (мг);
V – объем пробы, взятой для анализа (мл).
8. Методика определения сухого остатка (минерализация)
Фарфоровую чашку выдерживают в сушильном шкафу при температуре
110 °С 2 часа, затем охлаждают в эксикаторе и взвешивают на аналитических весах. Из общего объема профильтрованной через беззольный фильтр исследуемой воды 250 мл отливают небольшими порциями в фарфоровую чашку и выпаривают на водяной бане. После выпаривания чашку выдерживают в сушильном шкафу при температуре 110 °С до постоянной массы, охлаждают и взвешивают.
Расчет производится по формуле:
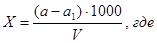
X – масса сухого остатка в исследуемом объеме воды (мг/дм³);
a – масса чашки с сухим остатком, мг;
а1 – масса пустой чашки;
V – объем воды, взятый для определения (мл).
 2020-01-14
2020-01-14 327
327








