Азотная кислота 25–50 % концентрации при нагревании активно окисляет молибденит [2,3]. Взаимодействие в основном описывается реакцией (5):
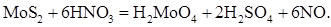 (5)
(5)
Это подтверждается близким соответствием между реальным расходом кислоты и ее количеством, рассчитанным по приведенной реакции [13]. Появление бурых паров диоксида азота – следствие взаимодействия закиси азота с кислородом воздуха.
Образующаяся молибденовая кислота частично остается в азотно-сернокислом маточном растворе, вероятно, преимущественно в форме сульфатокомплексов типа 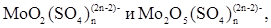 некоторая ее доля находится в растворе в коллоидной форме.
некоторая ее доля находится в растворе в коллоидной форме.
При температуре разложения 80–90 °С и концентрации кислоты выше 20 % в начальный период (30–40 мин) весь окислившийся молибден находится в растворе, однако затем быстро выделяется молибденовая кислота и резко снижается концентрация молибдена в растворе. С увеличением концентрации азотной кислоты и температуры скорость окисления молибденита возрастает, причем оба фактора способствуют коагуляции молибденовой кислоты. После разложения 27–30 % HNO3 при 90 °С кислые маточные растворы содержат 12–15 кг/м3 Мо, а после разложения 54 % кислотой 2,5–3 кг/м3.
Теоретический расход азотной кислоты для разложения концентрата с содержанием 48–50 % Мо примерно равен 3,16 т (60 % кислоты) на 1 т концентрата. Реальный расход зависит от способа разложения. При проведении процесса в системе, включающей регенерацию азотной кислоты из выделяющихся оксидов азота, общий расход кислоты близок к стехиометрическому.
Регенерация основана на хорошо известном процессе получения азотной кислоты, включающем следующие стадии:
- окисление NO кислородом (6):
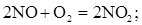 (6)
(6)
- абсорбцию NО2 в воде по реакции (7):
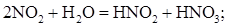 (7)
(7)
- диспропорционирование HNO2 по реакции (8):
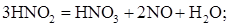 (8)
(8)
- результирующая реакция абсорбции NO2 (9):
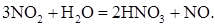 (9)
(9)
Учитывая реакции (6)–(8), можно, используя циркуляцию газов с одновременным введением в систему кислорода, существенно снизить расход азотной кислоты. Участие кислорода позволяет проводить процесс при расходе кислоты ниже стехиометрически необходимого количества (СНК) [13].
Разложение азотной кислотой проводят в аппаратуре из нержавеющей стали. При периодическом режиме целесообразно проводить двустадийное разложение по принципу противотока.
На одном из отечественных предприятий разложение ведут в непрерывном режиме [11]. Пульпа, состоящая из смеси концентрата и 30–35 % азотной кислоты, проходит последовательно через батарею цилиндрических аппаратов. В каждый аппарат подаются острый пар и воздух. Циркуляция пульпы внутри аппарата обеспечивает участие кислорода в регенерации азотной кислоты. Процесс проводят при температуре 90–100 °С. Расход азотной кислоты лишь немного выше стехиометрического количества.
Примерно 80 % молибдена (от исходного в пульпе) находится в осадках в составе молибденовой кислоты. Осадки выщелачивают аммиачной водой, растворы молибдата аммония перерабатывают по обычной схеме.
Весь рений весь переходит в маточный раствор, его концентрация составляет от 0,01 до 0,15 кг/м3 в зависимости от содержания в сырье. Молибден и рений извлекают из кислых маточных растворов, используя различные варианты экстракции или ионного обмена.
 2020-01-14
2020-01-14 198
198








