1.1. Электролит — вещество, расплав или раствор, который проводит электрический ток вследствие диссоциации на ионы.
(электролитическая диссоциация)[1]
Проводники бывают первого и второго рода. К проводникам первого рода относят проводники, обладающие электронной проводимостью (посредством движения электронов). К проводникам первого рода относят все металлы. К проводникам второго рода относят проводники с ионной проводимостью.
Электролиты — проводники второго рода, которые в растворе (или расплаве) состоят полностью или частично из ионов и обладают вследствие этого ионной проводимостью. Примерами электролитов могут служить кислоты, соли и основания.
В растворах электролитов не все частицы диссоциируют на ионы. Количество частиц, продиссоциировавших на ионы в растворе электролита, характеризуется степень электролитической диссоциации.
1.2. Степень электролитической диссоциации — отношение количества вещества, распавшегося в растворе на ионы к общему количеству растворенного вещества[2].

|
a-степень диссоциации
n-количество вещества, распавшегося на ионы
n0- общее количество растворенного вещества
На основе данного критерия можно проклассифицировать электролиты на три группы.
1.3. Классификация электролитов [3] [w5]
| сильные электролиты (α ≥ 70%) | средние электролиты (30% < α < 70%) | слабые электролиты (α ≤30%) |
| H2SO4,HNO3,HClO4 | HF | H2SiO3 |
1.4. Электролитическая диссоциация
Электролитическая диссоциация — процесс распада электролита на ионы при растворении его в воде или при плавлении.[4]
На процесс электрической диссоциации наряду с сольватирующей способностью частиц (сольватация - электростатическое взаимодействие между частицами (ионами, молекулами) растворенного вещества и растворителя) влияет также диэлектрическая проницаемость.
1.5. Диэлектрическая проницаемость [5]
| Относительная д.п.( ε) | Абсолютная д.п.(εε0) | ||
| Безразмерная величина, характеризующая свойства изолирующей (диэлектрической) среды. Данная величина показывает, во сколько раз взаимодействие между зарядами в однородной среде меньше, чем в вакууме. | величина, показывающая зависимость электрической индукции[i] от напряжённости электрического поля. | ||
| воздуха и большинства других газов в норм. условиях | большинство твёрдых или жидких веществ | вода | |
| ε£1 | 2£ε£8 | ε≈80 | |
Чем дольше диэлектрическая проницаемость, тем больше степень диссоциации.
1.6. Теория электролитической диссоциации. [6]
Классическая теория электролитической диссоциации базируется на идее о том, что не все частицы веществ диссоциируют, а лишь их часть. Отношение количества вещества, распавшегося в растворе на ионы, к общему количеству растворенного вещества характеризуется степенью диссоциации.
электролитическая диссоциация бинарного электролита KA
КА = К++А-
Константа диссоциации (см.приложение) Kd определяется активностями[w6] (см. приложение) катионов  , анионов
, анионов 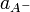 и недиссоциированных молекул
и недиссоциированных молекул  следующим образом:
следующим образом:

1.7. Сильные электролиты
Однако классическая теория электролитической диссоциации применима лишь к растворам слабых электролитов, т.к. она базируется на идее о неполной диссоциации веществ, а в таких веществах, которые относятся к сильным электролитам, диссоциация проходит практически полностью, и говорить в данном случае о степени диссоциации не имеет смысла.
 2020-01-14
2020-01-14 252
252







