ЭЛЕМЕНТЫ ФИЗИКИ ЯДРА
Содержание: Строение атомного ядра. Модели ядра. Природа ядерных сил. Радиоактивность. Закон радиоактивного распада, α –, β – и γ – излучение атомных ядер.
Строение атомного ядра
Состав ядра
Атомное ядро это положительно заряженная центральная часть атома, в которой сосредоточена вся масса атома.
Атомное ядро любого химического элемента (кроме атома водорода) состоит из протонов и нейтронов (рис. 12.1). Эти частицы называются нуклонами.
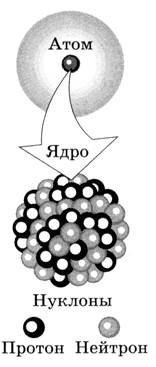
Рис. 12.1
| Характеристики нуклонов | Протон (p) | Нейтрон (п) |
| Электрический заряд | 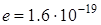 Кл Кл
| 0 |
| Масса | 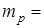 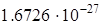 кг
= 1,00759 а.е.м.
= 938.28 МэВ кг
= 1,00759 а.е.м.
= 938.28 МэВ
|
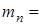 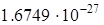 кг
= 1,00898 а.е.м.
= 939.55 МэВ кг
= 1,00898 а.е.м.
= 939.55 МэВ
|
Масса в 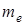
|
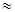 1836 1836 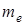
| 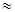 1839 1839 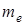
|
| Спин | 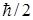
| 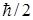
|
[ 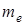 – масса электрона; e – элементарный заряд,
– масса электрона; e – элементарный заряд, 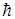 – постоянная Планка; протоны и нейтроны являются фермионами, а.е.м. – атомная единица массы. Одной атомной единице массы соответствует атомная единица энергии (а.е.э.): 1 а.е.э.=931.5016 МэВ.]
– постоянная Планка; протоны и нейтроны являются фермионами, а.е.м. – атомная единица массы. Одной атомной единице массы соответствует атомная единица энергии (а.е.э.): 1 а.е.э.=931.5016 МэВ.]
Магнитные моменты протона и нейтрона соответственно равны:
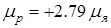 ,
, 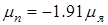 ,
,
где 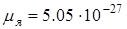
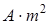 – ядерный магнетон.
– ядерный магнетон.
Характеристики атомного ядра
Основными величинами, характеризующими атомное ядро, являются зарядовое Z и массовое А числа.
| Характе- ристика | Обозначение | Определение |
| Зарядовое число | Z | Равно числу протонов в ядре, совпадает с порядковым номером химического элемента в Периодической системе элементов |
| Массовое число | A=Z+N | Равно числу нуклонов в ядре (числу протонов Z и нейтронов N) |
| Заряд ядра | +Ze | Поскольку атом нейтрален, то заряд ядра определяет и число электронов в атоме |
Итак, число Z равно количеству протонов в ядре и определяет его электрический заряд Ze. Его также называют атомным номером. Массовое число А определяет число нуклонов в ядре. Число же нейтронов в ядре
N = А – Z.
Символически эти характеристики ядра обозначают так:
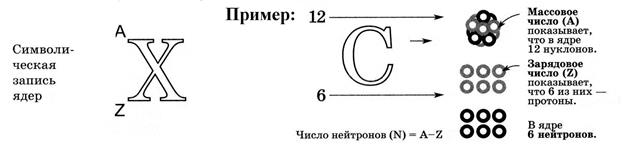
Изотопы, изобары, изотоны
| Изотопы | Изобары | Изотоны |
| Атомные ядра одного и того же элемента с различным числом нейтронов | Атомные ядра различных элементов с одинаковым массовым числом | Атомные ядра различных элементов с одинаковым числом нейтронов |
| Изотопы имеют одина-ковые Z, но разные А | Изобары имеют одинаковые А, но разные Z | Изотоны имеют одина-ковые N, но разные Z и А |
Пример:
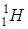  водород водород
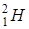  дейтерий дейтерий
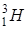 тритий тритий 
| Пример:
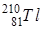 , , 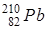 , , 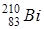
| Пример:
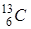 , , 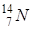 , , 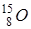
|
 2020-01-14
2020-01-14 291
291







