Под окислительно-восстановительными свойствами (ОВС) газовой фазы будем понимать способность окислять или восстанавливать материал, подвергаемый воздействию этой газовой фазы.
Мера окислительной способности газовой фазы –равновесное парциальное давление кислорода 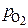 .
.
 можно найти из анализа частных равновесий
можно найти из анализа частных равновесий
2Н2 + О2 = 2Н2О; (1)
2СО + О2 = 2СО2; (2)
Константы равновесия реакций (1) и (2)


Отсюда
 (I)
(I)
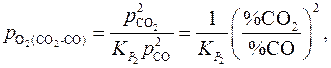 (II)
(II)
Если 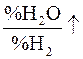 или
или  или
или  , то
, то 
Показатель, обобщающий влияние параметров  и Т, на окислительную способность газовой фазы – кислородный потенциал
и Т, на окислительную способность газовой фазы – кислородный потенциал 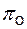 .
.
По определению 
По смыслу

Здесь  – изменение энергии Гиббса за счет перехода 1 моль О2 из стандартного состояния при 1 атм в произвольное состояние при
– изменение энергии Гиббса за счет перехода 1 моль О2 из стандартного состояния при 1 атм в произвольное состояние при  атм.
атм.
 ,
,
 – стандартный химический потенциал чистого кислорода с
– стандартный химический потенциал чистого кислорода с  атм
атм
 На рис. 10 представлены зависимости кислородного потенциала газовой фазы от температуры для некоторых парциальных давлений кислорода, логарифмы значений которых (в атм) указаны на отдельной шкале. Все линии выходят из одной точки О. Можно, отметив на шкале
На рис. 10 представлены зависимости кислородного потенциала газовой фазы от температуры для некоторых парциальных давлений кислорода, логарифмы значений которых (в атм) указаны на отдельной шкале. Все линии выходят из одной точки О. Можно, отметив на шкале  необходимое значение давления кислорода, соединить прямой отметку с точкой О и получить новую линию кислородного потенциала.
необходимое значение давления кислорода, соединить прямой отметку с точкой О и получить новую линию кислородного потенциала.
Как видно, при любой температуре кислородный потенциал газовой фазы со стандартным давлением кислорода
( = 1 атм) равен нулю. Кислородный потенциал фазы во всех других случаях определяется относительно этого стандартного состояния и при
= 1 атм) равен нулю. Кислородный потенциал фазы во всех других случаях определяется относительно этого стандартного состояния и при 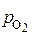 < 1 атм он отрицателен.
< 1 атм он отрицателен.
Анализ полученных уравнений показывает, что  увеличивается с увеличением отношений газов-окислителей
увеличивается с увеличением отношений газов-окислителей  и
и  к газам-восстановителям
к газам-восстановителям  и
и  , а также с ростом температуры. Указанное влияние температуры связано с уменьшением констант равновесия экзотермических реакций (1) и (2) при увеличении температуры.
, а также с ростом температуры. Указанное влияние температуры связано с уменьшением констант равновесия экзотермических реакций (1) и (2) при увеличении температуры.
Из уравнений (I) и (II) следует
 ;
;

Здесь  , (Дж),
, (Дж),
 (Дж)
(Дж)
Тогда для смеси  –
–  :
:
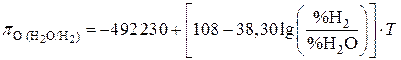 . (III)
. (III)
Для смеси СО – СО2:
 . (IV)
. (IV)
Используя расчетные формулы (III) и (IV), можно построить графики температурной зависимости кислородного потенциала для газовых смесей различного состава (рис.11 и 12). На рисунках в пределах полей графиков сплошными линиями показаны значения кислородного потенциала для ряда газовых смесей СО – СО2 и  –
–  , составы которых отмечены на выносных логарифмических шкалах. Семейства прямых линий берут начала в точке С для углеродсодержащей системы и точке H для водородсодержащей системы. Общие точки семейств и масштабные шкалы позволяют легко получать на диаграммах любые промежуточные линии кислородных потенциалов для газовых смесей различного состава. На диаграммах пунктирными линиями в пределах полей графиков даны семейства линий рисунка 10. Это позволяет определять величины равновесных давлений кислорода в различных газовых смесях по точкам пересечения сплошных и пунктирных линий, каждая из которых соответствует определенному давлению кислорода, отмечаемому на кислородной шкале.
, составы которых отмечены на выносных логарифмических шкалах. Семейства прямых линий берут начала в точке С для углеродсодержащей системы и точке H для водородсодержащей системы. Общие точки семейств и масштабные шкалы позволяют легко получать на диаграммах любые промежуточные линии кислородных потенциалов для газовых смесей различного состава. На диаграммах пунктирными линиями в пределах полей графиков даны семейства линий рисунка 10. Это позволяет определять величины равновесных давлений кислорода в различных газовых смесях по точкам пересечения сплошных и пунктирных линий, каждая из которых соответствует определенному давлению кислорода, отмечаемому на кислородной шкале.
Например, можно найти, что при 2000 K газовая смесь СО – СО2 с отношением  имеет
имеет  и значение кислородного потенциала
и значение кислородного потенциала  , а газовая смесь
, а газовая смесь  –
–  с таким же отношением
с таким же отношением 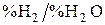 при 2000 K имеет
при 2000 K имеет 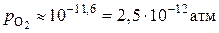 и значение кислородного потенциала
и значение кислородного потенциала  . Это означает, что из двух сравниваемых смесей углеродсодержащая является более окислительной, чем водородсодержащая
. Это означает, что из двух сравниваемых смесей углеродсодержащая является более окислительной, чем водородсодержащая
( и
и  ).
).

 Для оценки характера воздействия газовой фазы на конденсированные – окисление или восстановление – на диаграммы следует нанести линии зависимости
Для оценки характера воздействия газовой фазы на конденсированные – окисление или восстановление – на диаграммы следует нанести линии зависимости  от температуры для реакций образования оксидов. Методика такой оценки может быть показана на примере любой из диаграмм рис. 11 или 12. На каждой из этих диаграмм есть по одной линии
от температуры для реакций образования оксидов. Методика такой оценки может быть показана на примере любой из диаграмм рис. 11 или 12. На каждой из этих диаграмм есть по одной линии  для реакций (1) и (2) с участием, правда, газообразных оксидов. Это прямые 1 и 2, соответствующие отношениям
для реакций (1) и (2) с участием, правда, газообразных оксидов. Это прямые 1 и 2, соответствующие отношениям 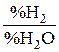 и
и  равным единице и логарифмам этих отношений равных нулю. Действительно, подстановка указанных отношений в уравнения (III) и (IV) приводит к выражениям:
равным единице и логарифмам этих отношений равных нулю. Действительно, подстановка указанных отношений в уравнения (III) и (IV) приводит к выражениям:  и
и  . Все точки на диаграммах, лежащие выше каждой из прямых 1 и 2, характеризуют системы со значениями
. Все точки на диаграммах, лежащие выше каждой из прямых 1 и 2, характеризуют системы со значениями  и
и  , превышающими соответствующие величины для газовых смесей
, превышающими соответствующие величины для газовых смесей  –
– 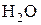 и СО – СО2 с соотношением компонентов равным единице. Поэтому эти системы оказываются окислительными по отношению к последним газовым смесям, и реакции (1) и (2) должны идти в сторону окисления
и СО – СО2 с соотношением компонентов равным единице. Поэтому эти системы оказываются окислительными по отношению к последним газовым смесям, и реакции (1) и (2) должны идти в сторону окисления  и СО.
и СО.
Напротив, газовые смеси, состояние которых отражено точками, лежащими ниже прямых 1 и 2, являются восстановительными для систем со стандартными отношениями реагентов, равными единице. В этих условиях реакции (1) и (2) должны идти в сторону диссоциации  и СО2.
и СО2.
 2020-01-14
2020-01-14 613
613








