Правило фаз Гиббса
f = k + 2 – n,
где f – число степеней свободы системы, вариантность системы;
k – число независимых компонентов;
n – число фаз.
Число независимых компонентов k = q–r,
где q – общее число веществ в системе; r – число независимых реакций между ними.
Частные равновесия (система C – О)
2С + О2 = 2СО; (8)
С + О2 = СО2; (9)
С + СО2 = 2СО; (10)
k = 2; n = 2 → f = 2.
Термодинамический анализ реакции взаимодействия углерода с СО2
Реакция С + СО2 = 2СО (10) называется реакцией газификации углерода и при наличии твердого углерода является определяющей равновесие в системе С – О.
Число степеней свободы в системе С – О равно  , то есть для количественного описания равновесного состояния достаточно значений T и P в качестве независимых параметров. На первом этапе расчета пренебрегаем малой величиной
, то есть для количественного описания равновесного состояния достаточно значений T и P в качестве независимых параметров. На первом этапе расчета пренебрегаем малой величиной  ..
..
Связь переменных можно отразить системой уравнений:

 .
.
Решение системы уравнений приводит к выражениям

Величину  находим из выражения
находим из выражения  реакции (2). Значения
реакции (2). Значения  и
и 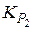 определяем из выражения
определяем из выражения  .
.
Необходимые для расчета величины 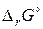 вычисляем из справочных зависимостей:
вычисляем из справочных зависимостей:  (Дж) и
(Дж) и  (Дж). Удобнее на основе указанных выражений получить температурные зависимости в виде
(Дж). Удобнее на основе указанных выражений получить температурные зависимости в виде  и
и  и использовать их для расчетов, результаты которых представлены в табл. 1.2 и графически (рис. 1.7 и 1.8).
и использовать их для расчетов, результаты которых представлены в табл. 1.2 и графически (рис. 1.7 и 1.8).
Анализ полученных данных указывает на увеличение концентрации СО с увеличением температуры, что согласуется с эндотермическим характером реакции газификации ( ). Уменьшение % CO с ростом давления связано с увеличением объема (числа моль газов) системы (
). Уменьшение % CO с ростом давления связано с увеличением объема (числа моль газов) системы ( ) при превращении
) при превращении 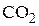 в СО по реакции (10). С ростом температуры и давления растет
в СО по реакции (10). С ростом температуры и давления растет  в системе в соответствии с происходящими изменениями в ее составе. Количественно это отражено кривыми линиями на рис. 1.7 и 1.8.
в системе в соответствии с происходящими изменениями в ее составе. Количественно это отражено кривыми линиями на рис. 1.7 и 1.8.
Рассмотрим состояние системы при Р = 1 атм.
Изобара 1 (см. рис. 1.7) разделяет диаграмму на две области различных состояний по отношению кравновесным. Запишем уравнение изотермы реакции (10)
 ,
,
где  и
и  – фактические, а
– фактические, а  и
и  – равновесные давления газов.
– равновесные давления газов.
В области выше равновесной кривой 1 при заданной Т фактический % СО больше равновесного % СО (точка кривой 1), значит,  . Поэтому здесь
. Поэтому здесь 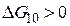 ; реакция (10) должна идти в обратном направлении, в сто-
; реакция (10) должна идти в обратном направлении, в сто-
Таблица 1.2
Результаты расчета равновесного состава газа в системе С – О
| Т, К | 
| 
|
| 
| 
|  , атм , атм
| 
| ||
| Р= 1 атм | |||||||||
| 700 | 2,65·10–4 | 1,1·1033 | 0,016 | 1,6 | 0,016 | 3,4·10–30 | –29,5 | ||
| 800 | 0,011 | 5,8·1027 | 0,098 | 9,8 | 0,11 | 1,4·10–26 | –25,8 | ||
| 900 | 0,19 | 4,6·1023 | 0,351 | 35,1 | 0,54 | 7,4·10–24 | –23,1 | ||
| 1000 | 1,9 | 2,4·1020 | 0,724 | 72,4 | 2,62 | 6,0·10–22 | –21,2 | ||
| 1100 | 12,5 | 5,0·1017 | 0,931 | 93,1 | 13,5 | 1,1·10–20 | –19,9 | ||
| 1200 | 60,3 | 2,9·1015 | 0,984 | 98,4 | 61,5 | 9,1·10–20 | –19,1 | ||
| Р= 10 атм | |||||||||
| 700 | 2,65·10–4 | 1,1·1033 | 0,051 | 0,51 | 0,005 | 3,5·10–29 | –28,5 | ||
| 800 | 0,011 | 5,8·1027 | 0,33 | 3,3 | 0,034 | 1,5·10–25 | –24,8 | ||
| 900 | 0,19 | 4,6·1023 | 1,29 | 12,9 | 0,15 | 9,9·10–23 | –22,0 | ||
| 1000 | 1,9 | 2,4·1020 | 35,1 | 35,1 | 0,54 | 1,4·10–20 | –19,8 | ||
| 1100 | 12,5 | 5,0·1017 | 65,6 | 65,6 | 1,91 | 5,5·10–19 |  18,3 18,3
| ||
| 1200 | 60,3 | 2,9·1015 | 87,3 | 87,3 | 6,9 | 7,2·10–18 |  17,1 17,1
| ||
|
| |||||||||
|
|
| ||||||||
| Рис. 1.7. Изобары равновесного состава газа СО – СО2 над твердым углеродом: | Рис. 1.8. Температурная зависимость
| ||||||||
рону распада СО с образованием твердого углерода и  . Таким образом, oбласть выше изобары – это область устойчивости углерода в контакте с
. Таким образом, oбласть выше изобары – это область устойчивости углерода в контакте с  , область распада СО. Обратные соотношения характерны для области ниже изобары. Это значит, что если поддерживать состав газовой фазы, удовлетворяющий соотношению
, область распада СО. Обратные соотношения характерны для области ниже изобары. Это значит, что если поддерживать состав газовой фазы, удовлетворяющий соотношению  , то углерод будет непрерывно расходоваться на взаимодействие с
, то углерод будет непрерывно расходоваться на взаимодействие с  с образованием устойчивого оксида СО. Соответственно данному анализу на диаграммах обозначены области устойчивости оксидов углерода.
с образованием устойчивого оксида СО. Соответственно данному анализу на диаграммах обозначены области устойчивости оксидов углерода.
Термодинамический анализ реакций взаимодействия
 2020-01-14
2020-01-14 440
440

 , атм
, атм

 в системе CO – CO2 – Cтв:
в системе CO – CO2 – Cтв: 






