Определяется поверхность теплообмена, необходимая для холодильника-конденсатора.
 ;
;
где  - тепловая нагрузка аппарата, кДж/с;
- тепловая нагрузка аппарата, кДж/с;
 - разность температур процесса,
- разность температур процесса,  ;
;
К-коэффициент теплопередачи, Вт/(м2град) 
Проводится расчет коэффициента теплопередачи К:
K=  ,
,
где δ-толщина стенки трубок, δ=2мм=0,002м;
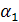 - коэффициент теплопередачи от газа к стенке, Вт/(м2град);
- коэффициент теплопередачи от газа к стенке, Вт/(м2град);
 - коэффициент теплоотдачи от стенки в окружающую среду, Вт/(м2град)
- коэффициент теплоотдачи от стенки в окружающую среду, Вт/(м2град) 
 - коэффициент теплопроводности стенки,
- коэффициент теплопроводности стенки,  =62,7 Вт(м град);
=62,7 Вт(м град);
Производится расчет  :
:
 =
=  ;
;
где  -критерий Нуссельта;
-критерий Нуссельта;
 -эквивалентный диаметр;
-эквивалентный диаметр;
При расчете коэффициент теплопередачи  нужно рассчитать критерий Re:
нужно рассчитать критерий Re:
Re=  ;
;
где -скорость нитрозного газа в аппарате, м/с;
 -динамический коэффициент вязкости, кг/с м2;
-динамический коэффициент вязкости, кг/с м2;
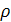 -плотность нитрозного газа.
-плотность нитрозного газа.
Для расчета скорости нитрозного газа и  необходимо рассчитать площадь сечения межтрубного пространства:
необходимо рассчитать площадь сечения межтрубного пространства:
 ;
;
где 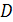 -диаметр корпуса холодильника-конденсатора, м;
-диаметр корпуса холодильника-конденсатора, м;
 – диаметр трубок, м;
– диаметр трубок, м;
 – число трубок, шт;
– число трубок, шт;
 -число ходов;
-число ходов;
 ;
;
где П-периметр трубок, м;

 =
= 
 =
=  ;
;
где  -секундный объем нитрозного газа в рабочих условиях,нм3/с;
-секундный объем нитрозного газа в рабочих условиях,нм3/с;
 =
=  =1,3
=1,3
 кг/м3;
кг/м3;
Тогда Rе= 
Rе 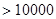
Nu=0,021 
 -поправочный коэффициент, учитывающий влияние на коэффициент теплоотдачи отношения длины трубы L к ее диаметру d,
-поправочный коэффициент, учитывающий влияние на коэффициент теплоотдачи отношения длины трубы L к ее диаметру d,  =1 [8]
=1 [8]
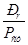 -для газов равен 1 [8]
-для газов равен 1 [8]
Pr-для многоатомных газов равен 1, тогда
Nu=0,0211 
 =782,37;
=782,37;
 Вт/м2 град;
Вт/м2 град;
По вышеописанной методике рассчитывается  ;
;
 =403,45 Вт/(м2град);
=403,45 Вт/(м2град);
K=  Вт/(м2град);
Вт/(м2град);
Определяется средняя разность температур процесса:
130 
40- 27
90 38
 =
=  =47,83
=47,83 
необходимая поверхность теплообмена составит:
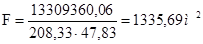
Исходя из расчетной величины холодильника-конденсатора в схеме применяется один стандартный холодильник-конденсатор с поверхностью теплообмена 1428 м2.
Запас поверхности теплообмена холодильника-конденсатора составляет:
 %.
%.
Реконструкция
Заменим оборотную воду на захоложенную. С понижением температуры повысится степень окисления оксида азота и выход азотной кислоты.
Целью материального баланса является определение равновесного состава газовой смеси, степени окисления оксида азота,состава газа после процесса конденсации.
Исходные данные для расчета [1]:
-Состав газа на входе в холодильник-конденсатор:
| Компонентный состав | об.% |
| NO | 3,09 |
| NO2 | 6,36 |
| O2 | 3,57 |
| N2 | 71,03 |
| H2O | 15,95 |
| Итого: | 100,00 |
Расчет ведем на 1000 кг 100,00%-й HNO3, получаемой в технологическом процессе.
Температура нитрозных газов на входе в холодильник, 0С 130.
Температура нитрозных газов на выходе из холодильника, 0С 55.
Температура захоложенной воды, 0С 25.
Давление в холодильнике, МПа 0,36
Диаметр холодильника-конденсатора, м 2,2.
Поверхность теплообмена, м2 1428.
Наружный диаметр трубок, м 0,05.
Расход газа, поступающего в холодильник-конденсатор 3789,17нм3 /т [1].
Зная состав газа, можно определить расход каждого компонента:
| Компонентный состав | кг/т | нм3/т | об.% |
| NO | 223,62 | 117,05 | 3,09 |
| NO2 | 148,55 | 241,01 | 6,36 |
| O2 | 186,37 | 135,19 | 3,57 |
| N2 | 3364,23 | 2691,38 | 71,03 |
| H2O | 61,44 | 604,54 | 15,95 |
| Всего: | 3984,21 | 3789,17 | 100 |
Расчет материального баланса процесса окисления нитрозного газа
Равновесие и скорость окисления оксида азота II.
NO+1/2O2=NO2 ΔrH(298) =112кДж/моль (3.1)
Зависимость константы равновесия от температуры по данным М. Боденштейна [3] выражается следующим уравнением:
LgK =Lg  +1,75LgT-0,0005T+2,839 (3.2)
+1,75LgT-0,0005T+2,839 (3.2)
Для расчета равновесной степени окисления оксида азота (II) выразим парциальные давления газов, входящие в уравнение равновесия, через общее давление в зависимости от начальной концентрации газа[3]:
Введем обозначения:
2a- начальная концентрация NO, мольн.доли;
b- начальная концентрация O2, мольн.доли;
xр- равновесная степень окисления NO, доли единицы;
Робщ- общее давление газа, атм.
Равновесные концентрации компонентов газовой смеси согласно реакции (3.1)составят:
| Компонент | Вход | Выход |
| NO | 2a | 2а(1-xp) |
| O2 | b | b-axp |
| NO2 | - | 2axp |
| Всего: | 1 | 1-axp |
Тогда парциальные давления компонентов газа при общем давлении 3,6 атм.в момент равновесия будут равны:
PNO=  Pобщ;
Pобщ;
РO2=  Pобщ;
Pобщ;
РNO2=  Pобщ;
Pобщ;
Подставляя значения парциальных давлений в уравнение равновесия, получим:
 =
=  P (3.3)
P (3.3)
Определим равновесную степень окисления оксида азота (II) для газа, содержащего 3,09% NO и 3,57% (об) O2 при 3,6 атм.
Тогда 2a=0,0309 м.д. a=0,01545м.д. b=0,0357м.д.
LgKр =− 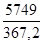 +1,75lg403-0,0005
+1,75lg403-0,0005  403+2,839
403+2,839
Откуда Кр=8,546 
Подставляя значения Кр и парциальных давлений в уравнение (3.3)получим:
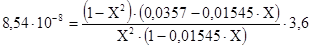

Из этого уравнения определяем 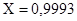 .
.
В результате протекания реакции (3.1) окисляется оксида азота (II):
VNO  Х=
Х= 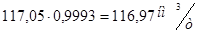 ;
;
Остается NO:
 ;
;
Расходуется кислорода на окисление
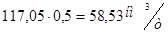 ;
;
Остается кислорода:
 ;
;
Содержание NO2 в нитрозном газе на выходе из аппарата:
 ;
;
Результаты расчета материального баланса процесса окисления представлены в таблице 3.1.
Таблица 3.1
Равновесный состав газовой смеси.
| Приход | Расход | ||||||||
| Компонентный состав | нм3/т | % об | кг/т | % масс | Компонентный состав | нм3/т | % об | кг/т | % масс |
| Нитрозный газ, в т.ч. | 3789,17 | 100,00 | 3984,21 | 100,00 | Нитрозный газ, в т.ч. | 3730,64 | 100,00 | 4150,4 | 100,00 |
| NO | 117,05 | 3,09 | 223,63 | 5,61 | NO | 0,08 | 0,002 | 0,09 | 0,002 |
| NO2 | 241,01 | 6,36 | 148,55 | 3,73 | NO2 | 357,98 | 9,59 | 597,98 | 14,41 |
| O2 | 135,19 | 3,57 | 186,37 | 4,68 | O2 | 76,66 | 2,05 | 126,66 | 3,05 |
| N2 | 2691,38 | 71,03 | 3364,23 | 84,44 | N2 | 2691,38 | 71,03 | 3364,23 | 81,05 |
| H2O | 604,54 | 15,95 | 61,44 | 1,54 | H2O | 604,54 | 15,95 | 61,44 | 1,48 |
| Всего: | 3789,17 | 100,00 | 3984,21 | 100,00 | Всего: | 3730,64 | 100,00 | 4150,4 | 100,00 |
Средняя температура нитрозных газов [4]:

где t1-температура нитрозного газа на входе в аппарат, 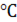
t2- температура нитрозного газа на выходе из аппарата, 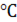
Свободный объем [1, 4]:


где Dв- внутренний диаметр трубок, м;
L-длина трубного пространства, м;
n-количество трубок, шт;
Объемная скорость нитрозного газа:
Wс =  =45,77нм3/с;
=45,77нм3/с;
где 380000-мощность производства по проекту, т100%HNO3 /г; 330 рабочих дней в году; 24 часа в сутках.
Время пребывания газа в окислителе:[4]

Определяем степень окисления NO (α).Находим:
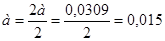 ;
;  ;
;
По справочным данным К при 87,21  [3]
[3]
Тогда 
где К-константа скорости реакции, а-начальная концентрация NO, мольн. доли, 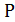 -общее давление, атм;
-общее давление, атм;
По номограмме В.А. Каржавина [3] определяем практическую степень окисления оксида азота: x=0,54.
Степень приближения практической степени превращения к равновесной:
 99,81%
99,81%
x 54% x=  x=54%
x=54%
Определяем практический состав газа.
Окисляется монооксида азота:
 ;
;
Остается:
 ;
;
Расходуется кислорода:
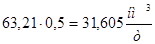 ;
;
Остается кислорода:
 ;
;
Содержание NO2 в нитрозном газе на выходе из аппарата:
241,01+63,21=304,22 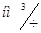 .
.
Таблица 3.2
Материальный баланс процесса окисления NO в NO2 в холодильнике-конденсаторе
| Приход | Расход | ||||||||
| Компонентный состав | нм3/т | % | кг/т | % | Компонентный состав | нм3/т | % | кг/т | % |
| NO | 117,05 | 3,09 | 223,62 | 5,61 | NO | 53,84 | 1,43 | 72,15 | 1,89 |
| NO2 | 241,01 | 6,36 | 148,55 | 3,73 | NO2 | 304,22 | 8,09 | 164,27 | 4,31 |
| O2 | 135,19 | 3,57 | 186,37 | 4,68 | O2 | 103,59 | 2,76 | 148,13 | 3,89 |
| N2 | 2691,38 | 71,03 | 3364,23 | 84,44 | N2 | 2691,38 | 71,63 | 3364,23 | 88,29 |
| H2O | 604,54 | 15,95 | 61,44 | 1,54 | H2O | 604,54 | 16,09 | 61,44 | 1,61 |
| Всего: | 3789,17 | 100,00 | 3984,21 | 100,00 | Всего: | 3757,57 | 100,00 | 3810,22 | 100,00 |
Газ после окисления NO в NO2 имеет следующий состав:
| Компонентный состав | нм3/т | об.% | кг/т | кмоль/т | %масс. |
| NO | 53,84 | 1,43 | 72,15 | 1,80 | 1,89 |
| NO2 | 304,22 | 8,09 | 164,27 | 3,57 | 4,31 |
| O2 | 103,59 | 2,76 | 148,13 | 4,63 | 3,89 |
| N2 | 2691,38 | 71,63 | 3364,23 | 120,15 | 88,29 |
| H2O | 604,54 | 16,09 | 61,44 | 3,41 | 1,61 |
| Всего: | 3757,57 | 100 | 469,79 | 133,56 | 100 |
Выразим парциальное давление паров воды через общее давление и концентрацию:
PH2O=Pобщ  ;
;
Тогда  ;
;
Процесс в холодильнике-конденсаторе происходит при следующих условиях:
-концентрация HNO3 60-65%масс.
-температура 60-65°C
Упругость паров воды над 65-% кислотой при 65°С-54,5мм.рт.ст. [3].
Принимаем, что на выходе из холодильника-конденсатора нитрозные газы содержат Х паров воды, тогда
PH2O=54,5мм.рт.ст.
Pобщ = 0,36 МПа;
1мм.рт.ст.-133,3Па
Х-0,36  106 Па Х=
106 Па Х= 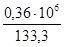
 =2700,07мм.рт.ст;
=2700,07мм.рт.ст;
 ; Х= 2,68кмоль/т
; Х= 2,68кмоль/т
133,56- количество газа, прошедшее через холодильник- конденсатор в кмоль/т;
3,42-количество водяных паров на входе в холодильник-конденсатор.
Конденсируется паров воды:
 кмоль/т или 13,14кг/т;
кмоль/т или 13,14кг/т;
В этом количестве воды будет растворено У кг/т моногидрата азотной кислоты с образованием 65-% кислоты (3.4), тогда можно записать, что  , тогда У=19,29кг/т.
, тогда У=19,29кг/т.
Остается воды:
 кг/т;
кг/т;
Х1 13,14 19,29 Х2
3NO2+H2O=2HNO3+NO (3.4)
3  18 2
18 2  30
30
Отсюда Х1=21,13кг/т;
Остается оксида азота (IV):  кг/т;
кг/т;
Х2=4,59кг/т;
Остается оксида азота (II):  кг/т;
кг/т;
Количество сконденсировавшейся азотной кислоты:
19,29кг/т-65%
mвсего-100% mвсего=29,68кг/т;
Таблица 3.3
Состав газа после процесса конденсации
| Компонентный состав | нм3/т | % об | кг/т | % масс | кмоль/т |
| I.Нитрозный газ в т.ч. | 3117,43 | 100,00 | 3954,53 | 100,00 | 137,13 |
| NO | 179,69 | 5,76 | 228,21 | 5,77 | 5,71 |
| NO2 | 95,09 | 3,05 | 127,42 | 3,22 | 2,77 |
| O2 | 90,9 | 2,92 | 186,37 | 4,71 | 5,82 |
| N2 | 2691,38 | 86,33 | 3364,23 | 85,07 | 120,15 |
| H2O | 60.37 | 1,94 | 48,3 | 1,22 | 2,68 |
| II.Азотная кислота в т.ч. | 27,8 | 100,00 | 29,68 | 100,00 | 0,89 |
| а)HNO3(100%) | 12,11 | 43,56 | 19,29 | 65 | 0,31 |
| б)H2O | 15,69 | 56,44 | 10,39 | 35 | 0,58 |
| Всего: | 3984,21 |
Таблица 3.4.
Материальный баланс холодильника-конденсатора нитрозных газов.
| Приход | Расход | ||||||||
| Компонентный состав | нм3/т | %об. | кг/т | % масс. | Компонентный состав | нм3/т | % об. | кг/т | % масс. |
| I.Нитрозный газ, в т.ч. | I.Нитрозный газ, в т.ч. | 3117,43 | 100,00 | 3954,53 | 100,00 | ||||
| NO | 117,05 | 3,09 | 223,62 | 5,61 | NO | 179,69 | 5,76 | 228,21 | 5,71 |
| NO2 | 241,01 | 6,36 | 148,55 | 3,73 | NO2 | 95,09 | 3,05 | 127,42 | 3,22 |
| O2 | 135,19 | 3,57 | 186,37 | 4,68 | O2 | 90,9 | 2,92 | 186,37 | 4,71 |
| N2 | 2691,38 | 71,03 | 3364,23 | 84,44 | N2 | 2691,38 | 86,33 | 3364,23 | 85.07 |
| H2O | 604,54 | 15,95 | 61,44 | 1,54 | H2O | 60,37 | 1,94 | 48,3 | 1,22 |
| Всего: | 3789,17 | 100,00 | 3984,21 | 100,00 | II.Азотная кислота в т.ч. | 29,68 | 100,00 | ||
|
| а)HNO3(100%) | 19,29 | 65 | ||||||
| б)H2O | 10,39 | 35 | |||||||
| Всего: | 3984,21 | ||||||||
Целью теплового расчета является определение количества воды, необходимой для охлаждения нитрозного газа при данных условиях.
Исходные данные:
-температура нитрозных газов на входе в холодильник, 0С 130
-температура нитрозных газов на выходе из холодильника, 0С 55
-температура охлаждающей воды, 0С 25
Температурные ряды и теплоты образования веществ, участвующих в процессе.
| Соединение | Температурный ряд | Энтальпия, кДж/моль | ||
| A | b | c’ | ||
| O2 | 31,46 | 3,39 
| -3,37 
| 0 |
| N2 | 27,87 | 4,27 
| 0 | 0 |
| H2O | 30 | 10,71 
| 0,33 | -241,84 |
| NO | 29,58 | 3,85 
| -0,59 
| 90,37 |
| NO2 | 42,93 | 8,54 
| -6,74 
| 33,89 |
Тепловой баланс холодильника-конденсатора
Тепловой баланс холодильника-конденсатора имеет следующий вид:
Q1+Q2+Q3+Q4+Q5=Q1’+Q2’+Q3’+Q4’,
где Q1-тепло, вносимое нитрозным газом;
Q2-тепло окисления монооксида азота в диоксид;
Q3-тепло образования моногидрата;
Q4-тепло разбавления моногидрата;
Q5-тепло конденсации воды;
Q1’-тепло, уходящее с нитрозным газом;
Q2’-тепло, уходящее с кислотой;
Q3’-теплопотери;
Q4’-тепло отводимое с охлаждающей водой;
Приход тепла.
Рассчитаем теплоемкости компонентов газовой смеси на входе в холодильник-конденсатор при температуре 130  или 403К.
или 403К.

Теплоемкость кислорода:

Теплоемкость азота:

Теплоемкость воды:

Теплоемкость оксида азота (II):

Теплоемкость оксида азота (IV):

Средняя теплоемкость нитрозного газа на входе в аппарат:
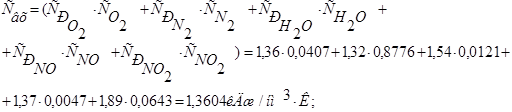
1)Тепло, вносимое нитрозным газом:
Q1= 
где V –объем нитрозного газа, проходящего через холодильник-конденсатор, нм3/т;
tвх- температура нитрозного газа на входе в холодильник-конденсатор, 
2)Тепло окисления монооксида азота в диоксид:
Q2= 
где 57070,05- теплота окисления монооксида азота в диоксид, кДж/кмоль;
3)Тепло образования моногидрата:
Q3= 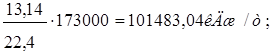
где 173000-теплота образования азотной кислоты, кДж/кмоль;
13,14-количество сконденсировавшихся паров воды, кг/т;
4)Тепло разбавления моногидрата:
Q4= 
где 19,29-количество растворенного моногидрата азотной кислоты,кг;
31600-теплота разбавления моногидрата кислоты, кДж/кмоль;
5)Тепло конденсации воды:
Q5=  ;
;
Где 4939,6-тепло конденсации воды, кДж/кмоль;
Общий приход тепла:  Q=1593275,84кДж/т;
Q=1593275,84кДж/т;
Расход тепла:
Рассчитаем теплоемкости компонентов газовой смеси на выходе в холодильник-конденсатор при температуре 55  или 328К.
или 328К.
Теплоемкость кислорода: 
Теплоемкость азота:

Теплоемкость воды:

Теплоемкость оксида азота (II):

Теплоемкость оксида азота (IV):

Средняя теплоемкость нитрозного газа на выходе из аппарата:

1)Тепло, уходящее с нитрозным газом:
Q1’=  =
= 
где  - температура нитрозного газа на выходе из холодильника, 0С;
- температура нитрозного газа на выходе из холодильника, 0С;
2)Тепло, уходящее с кислотой:
Q2’ =mk 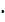 Ck
Ck 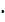 tk =
tk =  где
где
mk-масса кислоты, кг/т;
Ck-теплоемкость кислоты, кДж/кмоль;
tk- температура кислоты, 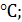
3) Теплопотери:
Принимаем, что потери тепла в окружающую среду составляют 3% от общего количества, поступающего в аппарат.
Q3’= 
4)Тепло отводимое с охлаждающей водой;
Q4’=  Q-(Q1’+ Q2’+ Q3’)=
Q-(Q1’+ Q2’+ Q3’)=
 ;
;
Таблица 3.3.2.1
Тепловой баланс холодильника-конденсатора.
| Статьи прихода | кДж/т | % | Статьи расхода | кДж/т | % |
| 1) Тепло с газами | 670122,29 | 42,05 | 1)Тепло с газами | 483545,21 | 30,34 |
| 2) Тепло окисления | 161044,55 | 10,11 | 2)Тепло с кислотой | 3085,24 | 0,19 |
| 3) Тепло образования моногидрата | 101483,04 | 6,37 | 3)Теплопотери | 47798,27 | 2,99 |
| 4) Тепло разбавления моногидрата | 9675,62 | 0,61 | 4)Тепло, уходящее с водой | 1058847,12 | 66,46 |
| 5) Тепло конденсации воды | 650950,34 | 40,86 | |||
| Итого: | 1593275,84 | 100 | Итого: | 1593275,84 | 100 |
Рассчитаем количество воды, необходимой для охлаждения нитрозного газа при данных условиях. Принимаем температуру поступающей воды 40  уходящей воды 50
уходящей воды 50 
m= 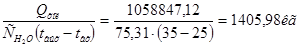
где  -теплоемкость воды, Дж/моль град;
-теплоемкость воды, Дж/моль град;
 -тепло охлаждающей воды, кДж/т;
-тепло охлаждающей воды, кДж/т;
Определяется поверхность теплообмена, необходимая для холодильника-конденсатора.
 ;
;
где  - тепловая нагрузка аппарата, кДж/с;
- тепловая нагрузка аппарата, кДж/с;
 - разность температур процесса,
- разность температур процесса,  ;
;
К-коэффициент теплопередачи, Вт/(м2град) 
Проводится расчет коэффициента теплопередачи К:
K=  ,
,
где δ-толщина стенки трубок, δ=2мм=0,002м;
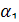 - коэффициент теплопередачи от газа к стенке, Вт/(м2град);
- коэффициент теплопередачи от газа к стенке, Вт/(м2град);
 - коэффициент теплоотдачи от стенки в окружающую среду, Вт/(м2град)
- коэффициент теплоотдачи от стенки в окружающую среду, Вт/(м2град) 
 - коэффициент теплопроводности стенки,
- коэффициент теплопроводности стенки, 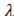 =62,7 Вт(м град);
=62,7 Вт(м град);
Производится расчет 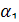 :
:
 =
= 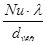 ;
;
где  -критерий Нуссельта;
-критерий Нуссельта;
 -эквивалентный диаметр;
-эквивалентный диаметр;
При расчете коэффициент теплопередачи  нужно рассчитать критерий Re:
нужно рассчитать критерий Re:
Re=  ;
;
где -скорость нитрозного газа в аппарате, м/с;
 -динамический коэффициент вязкости, кг/с м2;
-динамический коэффициент вязкости, кг/с м2;
 -плотность нитрозного газа.
-плотность нитрозного газа.
Для расчета скорости нитрозного газа и  необходимо рассчитать площадь сечения межтрубного пространства:
необходимо рассчитать площадь сечения межтрубного пространства:
 ;
;
где  -диаметр корпуса холодильника-конденсатора, м;
-диаметр корпуса холодильника-конденсатора, м;
 – диаметр трубок, м;
– диаметр трубок, м;
 – число трубок, шт;
– число трубок, шт;
 -число ходов;
-число ходов;
 ;
;
где П-периметр трубок, м;

 =
= 
 =
=  ;
;
где  -секундный объем нитрозного газа в рабочих условиях,нм3/с;
-секундный объем нитрозного газа в рабочих условиях,нм3/с;
 =
=  =1,3
=1,3 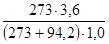 кг/м3;
кг/м3;
Тогда Rе= 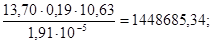 ;
;
Rе 
Nu=0,021 
 -поправочный коэффициент, учитывающий влияние на коэффициент теплоотдачи отношения длины трубы L к ее диаметру d,
-поправочный коэффициент, учитывающий влияние на коэффициент теплоотдачи отношения длины трубы L к ее диаметру d, 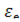 =1 [8]
=1 [8]
 -для газов равен 1 [8]
-для газов равен 1 [8]
Pr-для многоатомных газов равен 1, тогда
Nu=0,0211 
 =1782,37;
=1782,37;
 Вт/м2 град;
Вт/м2 град;
По вышеописанной методике рассчитывается  ;
;
 =403,45 Вт/(м2град);
=403,45 Вт/(м2град);
K=  Вт/(м2град);
Вт/(м2град);
Определяется средняя разность температур процесса:
130- 55
35- 25
95 30
 =
=  =56,52
=56,52 
необходимая поверхность теплообмена составит:

Исходя из расчетной величины холодильника-конденсатора в схеме применяетя один стандартный холодильник-конденсатор с поверхностью теплообмена 1428 м2.
Запас поверхности теплообмена холодильника-конденсатора составляет:
 %.
%.
 2020-01-14
2020-01-14 390
390








