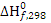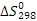Цель данного раздела состоит в анализе термодинамической вероятности протекания основной и побочных реакций в заданном интервале температур. Расчёт энергии Гиббса ведём по методу Тёмкина-Шварцмана [2]. Необходимые для расчета энтальпии (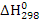 ) и энтропии (
) и энтропии (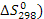 образования, а также коэффициенты (а, в, с) в уравнениях теплоёмкости определяем из (3) и (4). Расчёт энергии Гиббса ведём при температурах 380°С и 420°С. Необходимые для расчета коэффициенты Тёмкина-Шварцмана определяем по [2].
образования, а также коэффициенты (а, в, с) в уравнениях теплоёмкости определяем из (3) и (4). Расчёт энергии Гиббса ведём при температурах 380°С и 420°С. Необходимые для расчета коэффициенты Тёмкина-Шварцмана определяем по [2].
Для Т = 653К (380°С) М0 = 0,24 М1 = 0,0967·103 М2 = 0,0406 · 106
Для Т = 693К (420°С) М0 = 0,2735 М1 = 0,1125 · 103 М2 = 0,0484 · 106
Значения 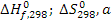 , в, с приведены в таблице 1.2.
, в, с приведены в таблице 1.2.
Таблица1.2
| Соединения |
кДж/моль |
Дж/(моль·К) | Cp, Дж/(моль·К) | ||
| a | в · 103 | с · 106 | |||
| Пропилен | 20,41 | 266,94 | 12,44 | 188,38 | - 47,60 |
| Кислород | 0 | 205,04 | 31,46 | 3,3 | - 3,77 |
| Акролеин | - 80,77 | 287,90 | 31,26 | 150,0 | - 49,06 |
| Вода | - 241,81 | 188,72 | 30,0 | 10,71 | 0,33 |
| СО2 | - 393,51 | 213,66 | 44,14 | 9,04 | - 8,54 |
| СО | - 110,53 | 197,55 | 28,41 | 4,10 | - 0,46 |
определяем термодинамическую вероятность протекания реакции (1):
 СН2 = СН –– СН3 + О2 СН2 = СН –– СНО + Н2О
СН2 = СН –– СН3 + О2 СН2 = СН –– СНО + Н2О
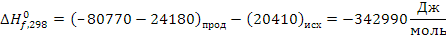
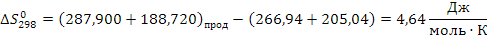
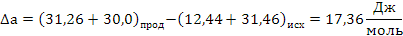
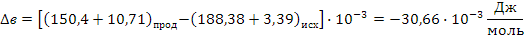
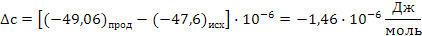
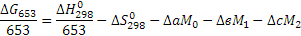
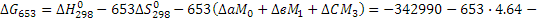
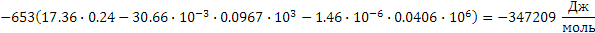
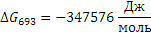
Поскольку энергия Гиббса для реакции (1) при температурах 653 и 693К принимает отрицательное значение, то в интервале температур от 653 до 693К реакция (1) термодинамически возможна.
Определяем термодинамическую вероятность протекания реакции (2):
 С3Н6 + 4,5О2 3СО2 + 3Н2О
С3Н6 + 4,5О2 3СО2 + 3Н2О
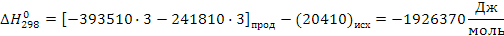
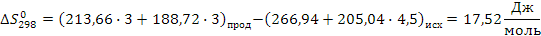
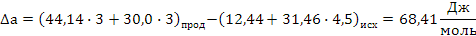
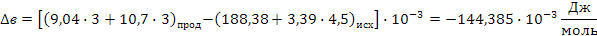
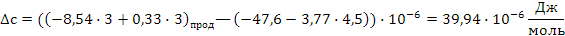
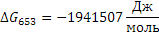
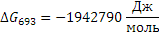
Поскольку энергия Гиббса для реакции (2) при температурах 653 и 693К принимает отрицательное значение, то в интервале температур от 653 до 693К реакция (2) термодинамически возможна.
Определяем термодинамическую вероятность протекания реакции (3):
 С3Н6 + 3О2 3СО + 3Н2О
С3Н6 + 3О2 3СО + 3Н2О
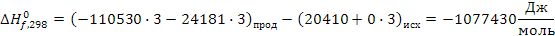
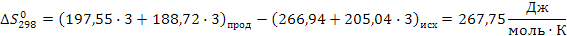
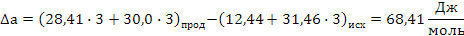
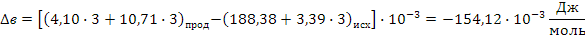
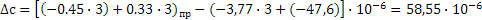
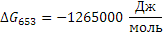
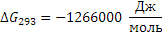
Таким образом в интервале температур от 653 до 693К все три реакции термодинамически возможны.
 2020-01-14
2020-01-14 133
133