Физические основы процесса сгорания в двигателях с искровым зажиганием и дизелях. Основные требования, предъявляемые к сгоранию топлива и тепловыделению в поршневых ДВС.
Физико-химические основы теории теории горения
Процесс сгорания занимает особое место среди остальных процессов рабочего цикла При сгорании топлива рабочее тело претерпевает химические и физические изменения. Характер протекания этих изменений существенно влияет на основные показатели работы двигателя и на его эксплуатационную надежность.
Сложность протекания процесса сгорания ограничивает возможность точного определения изменения состояния рабочего тела в течение этого периода. Однако современное состояние теории горения и богатый экспериментальный материал позволяют деть достаточно четкие рекомендации по улучшению рабочего процесса двигателей внутреннего сгорания.
Большой вклад в развитие теории горения сделан академиям Н. Н. Семеновым и его школой.
При анализе процессов горения академик Н. Н. Семёнов использовал теорию окисления углеводородов академика А. Н. Баха. Согласно этой теории при нагревании до некоторой температуры в молекуле кислорода обрывается одна связь. К свободным связям присоединяются радикалы, образовавшиеся в результате распада сложных углеводородных молекул, и образуются нестойкие активные вещества — перекиси и гидроперекиси. В результате разрушения их внутримолекулярных связей образуются альдегиды  ,дальнейшее окисление которых приводит к образованию кислот, воды, окиси углерода и углекислого газа.
,дальнейшее окисление которых приводит к образованию кислот, воды, окиси углерода и углекислого газа.
Теория академика А. Н. Баха позволяет правильно рассчитать конечный результат химических реакций, не вскрывая механизм их протекания.
Н. Н. Семенов открыл разветвленные цепные реакции, создал теорию теплового и цепного взрыва.
В соответствии с этой теорией цепная реакция начинается с зарождения одного или нескольких активных центров, способных вступать в соединения без какой-либо дополнительной активизации и давать начало первым звеньям цепи. В конце каждого звена вновь появляются активные центры. При этом в случае образования одного активного центра цепь продолжается в одном направлении (неразветвленная цепь), а при появлении двух и более центров цепь продолжается в нескольких направлениях (разветвленная цепь).
Цепная реакция будет продолжаться до тех пор, пока не произойдет обрыва цепи из-за гибели активных центров в результате их соударения между собой, со стенками сосуда, либо с молекулами инертных примесей.
Сущность цепного механизма протекания химических реакций состоит в том, что любое химическое превращение проходит через ряд промежуточных стадий с образованием промежуточных продуктов и активных центров.
Механизм окисления углеводородов, входящих в состав моторных топлив, гораздо сложнее, чем а реакции окисления водорода, и не до конца еще изучен. Активными центрами первых стадий цепных реакции сложных углеводородов могут быть перекиси, гидроперекиси, альдегиды, радикалы и т. п.
При оценке продолжительности протекания процесса сгорания необходимо различать скорость сгорания и скорость распространения пламени.
Скорость сгорания (скорость протекания химической реакции) характеризуется количеством вещества, сгорающего в единицу времени. Таким образом, скорость сгорания определяет интенсивность протекания химической реакции независимо от характера распространения реакции по объему, занимаемому горючей смесью.
Под скоростью распространения фронта пламени понимается скорость распространения фронта пламени по объему камеры сгорания.
Скорость химической реакции зависит от химических и физических свойств реагирующих веществ, от концентрации их в объеме и от ряда других факторов (особенно от температуры). Увеличение скорости химических реакций с повышением температуры объясняется увеличением доли активных молекул, т. е. молекул. обладающих достаточной энергией для разрушения внутримолекулярных связей. При увеличении температуры возрастает кинетическая энергия молекул и число активных столкновений, результатом чего является увеличение скорости химической реакции.
Зависимость скорости химических реакций от температуры выражается законом Аррениуса:
 ,
,
где Со — константа, зависящая от природы реагирующих веществ и их концентрации;
Е — энергия активации, составляющая для углеводородных топлив 20—40 ккал/киломоль;
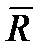 — мольная газовая постоянная, ккал/(киломоль-°С);
— мольная газовая постоянная, ккал/(киломоль-°С);
Т — температура реагирующей смеси.
В соответствии с законом Аррениуса процессы окисления при низких температурах протекают медленно. Для воспламенения топлива необходимо увеличить энергию молекул до такого уровня, при котором скорость реакции резко возрастает. При превышении некоторого критического значения температуры начнется быстрый саморазогрев смеси, завершающийся самовоспламенением. Обычно самовоспламенение происходит при нарушении равновесия между скоростью выделения тепла в результате химических реакций и скоростью теплоотвода.

Рисунок 7.1. Изменение скоростей тепловыделения и теплоотвода в зависимости от температуры реагирующей смеси

Рисунок 7.2. К определению условий теплового взрыва
Скорость тепловыделения пропорциональна скорости химической реакции и изменяется по экспоненциальному закону:
 .
.
Скорость теплоотвода определяется выражением
 ,
,
где а — коэффициент теплоотдачи;
Р — площадь поверхности теплоотдачи;
Т — температура смеси;
То — температура стенок.
На Рисунок 7.1 приведено изменение скоростей тепловыделения и теплоотвода в зависимости от температуры реагирующей смеси.
Точка пересечения прямой 7 (теплоотвод от стенок при То) с кривой тепловыделения при Т/ является точкой теплового равновесия. Однако дальнейшее ускорение реакции оказывается невозможным, так как скорость теплоотвода будет превышать скорость тепловыделения.
Если температура стенок будет такой, что скорость тепловыделения будет превышать скорость теплоотвода (прямая 3, отвечающая начальной температуре Ту"), то будет происходить. непрерывный саморазогрев реагирующей смеси и наступит самовоспламенение.
Очевидно, что критические условия самовоспламенения определяются касанием кривой тепловыделения и прямой теплоотвода 2. При этом начальная температура Тц определяет предел самовоспламенения. Минимальная темперагура первоначального нагрева смеси, по достижении которой происходит интенсивный саморазогрев смеси и воспламенение ее при данных условиях, называется температурой самовоспламенения.
При нагревании горючей смеси в процессе сжатия сущность явлений остается такой же, хотя воспламенение развивается несколько в других условиях.
В этом случае температура стенок цилиндра всегда ниже температуры сжатой смеси, поэтому до достижения некоторой критической температуры сжатия (Рисунок 7.2) скорость теплоотвода превышает скорость тепловыделения и топливо не воспламеняется. Воспламенение может произойти только при нагревании горючей смеси до температуры больше критической (Т).
В зависимости от способа повышения энергии реагирующих молекул различают принудительное воспламенение и самовоспламенение.
В случае принудительного воспламенения пламя образуется за счет сильного нагрева небольшого объема горючей смеси от постороннего источника тепла, например, от электрической свечи.
При самовоспламенении пламя образуется вследствие разогрева до определенной температуры всей горючей смеси. Самовоспламенение достигается в двигателях путем предварительного сжатия рабочего тела, в связи с чем такой способ называется воспламенением от сжатия.
Несмотря на определенные различия указанных способов образования пламени механизм воспламенения остается одинаковым и заключается в прогрессивном самоускорении химических реакций.
По своей сущности воспламенение в ДВС относится к цепочно-тепловым процессам. Начальная стадия процесса, как правило, является чисто цепочной и протекает с очень незначительным выделением тепла. В дальнейшем скорость цепных реакций возрастает и выделение тепла увеличивается.
Отрезок времени, (Рисунок 7.3), в течение которого скорость химической реакции настолько мала, что ее практически трудно обнаружить, называют периодом индукции, или периодом задержки самовоспламенения. Однако для двигателей при исследовании их рабочего процесса основное значение имеет характер изменения давления в цилиндре, поэтому на практике задержкой воспламенения называют период между началом впрыска топлива и началом быстрого повышения давления в цилиндре.

Рисунок 7.3. Изменение скорости цепной реакции по времени
Условно период задержки самовоспламенения можно представить как сумму:
 ,
,
где  — время, затрачиваемое на физические процессы подготовки горючей смеси (распад струи топлива на капли,
— время, затрачиваемое на физические процессы подготовки горючей смеси (распад струи топлива на капли,
образование факела, нагревание капель и их испарение и др.;
 — время, затрачиваемое на химические процессы подготовки горючей смеси.
— время, затрачиваемое на химические процессы подготовки горючей смеси.
Относительно низкая температура в цилиндре дизельного двигателя обуславливает сравнительно малые скорости химических реакции, которое и определяют продолжительность периода задержки самовоспламенения. Продолжительность периода задержки самовоспламенения измеряется либо в градусах поворота коленчатого вала, либо в секундах.
В случае сильного переобогащения или переобеднения смеси скорость распространения пламени значительно снижается и пламя даже может погаснуть, что является следствием резкого снижения концентрации одного из реагентов, приводящего к такому уменьшению скорости реакции, когда тепловыделение не компенсирует теплоотвод.
Существуют концентрационные пределы распространения пламени. Верхним пределом распространения пламени называется состав смеси, при котором дальнейшее увеличение количества топлива в смеси (обогащенная смесь) делает смесь негорючей. Нижним пределом распространения пламени называется состав смеси, при котором дальнейшее обеднение смеси делает ее негорючей. В карбюраторных двигателях с искровым зажиганием 
 0,3, а
0,3, а  1,З. Следует иметь в виду, что пределы распространения пламени зависят от условий их определения.
1,З. Следует иметь в виду, что пределы распространения пламени зависят от условий их определения.
В дизеле топливо начинает подаваться в цилиндр в конце процесса сжатия, поэтому из-за неравномерности распределения частиц топлива по объему цилиндра средняя величина коэффициента избытка воздуха не может характеризовать местные коэффициенты избытка воздуха в зонах.
 2020-04-07
2020-04-07 457
457







