Двойственная природа электрона. В 1905 г. А. Эйнштейн предсказал, что любое излучение представляет собой поток квантов энергии, называемых фотонами. Из теории Эйнштейна следует, что свет имеет двойственную (корпускулярно-волновую) природу.
В 1924 г. Луи де Бройль (Франция) выдвинул предположение, что электрон также характеризуется корпускулярно-влновым дуализмом. Позднее это было подтверждено на опытах по дифракции на кристаллах. Де Бройль предложил уравнение, связывающее длину волны λ электрона или любой другой частицы с массой m и скоростью ν,
 . (1.5)
. (1.5)
Волны частиц материи де Бройль назвал материальными волнами. Они свойственны всем частицам или телам. Однако, как следует уравнения (1.5), для макротел длина волны настолько мала, что в настоящее время не может быть обнаружена. Так, для тела с массой 1000 кг, двигающегося со скоростью 108 км/ч (30 м/с) λ = 2,21·10-38 м.
В 1927 г. В. Гейзенберг (Германия) постулировал принцип неопределенности, согласно которому положение и импульс движения субатомной частицы (микрочастицы) принципиально невозможно определить в любой момент времени с абсолютной точностью. В каждый момент времени можно определить только лишь одно из этих свойств. Э. Шредингер (Австрия) в 1926 г. вывел математическое описание поведения электрона в атоме.
Работы Планка, Эйнштейна, Бора, де Бройля, Гейзенберга, а также Шредингера, предложившего волновое уравнение, заложили основу квантовой механики, изучающей движение и взаимодействие микрочастиц.
Орбиталь. В соответствие с квантово-механическими представлениями невозможно точно определить энергию и положение электрона, поэтому в квантово-механической модели атома используют вероятностный подход для характеристики положения электрона. Вероятность нахождения электрона в определенной области пространства описывается волновой функцией ψ, которая характеризует амплитуду волны, как функцию координат электрона. В наиболее простом случае эта функция зависит от трех пространственных координат и называется орбиталью. В соответствии с определением ψ, орбиталью называется область пространства, в котором наиболее вероятно нахождение электрона. Необходимо заметить, что понятие орбиталь существенно отличается от понятия орбита, которая в теории Бора означала путь электрона вокруг ядра атома. Величина области пространства, которую занимает орбиталь, обычно такова, чтобы вероятность нахождения электрона внутри нее составляла не менее 95 %.
Так как электрон несет отрицательный заряд, то его орбиталь представляет собой определенное распределение заряда, которое получило название электронного облака.
Квантовые числа. Для характеристики поведения электрона в атоме введены квантовые числа: главное, орбитальное, магнитное и спиновое.
Главное квантовое число n определяет энергию и размеры электронных орбиталей. Главное квантовое число принимает значения 1,2,3,4,5,… и характеризует оболочку или энергетический уровень. Чем больше n, тем выше энергия. Оболочки (уровни) имеют буквенные обозначения: К (n = 1), L (n = 2), M (n = 3), N (n = 4), Q (n = 5), переходы электронов с одной оболочки (уровня) на другую сопровождаются выделение квантов энергии, которые могут проявиться в виде спектров (см. рис. 1.1).
Орбитальное квантовое число l определяет форму атомной орбитали. Электронные оболочки расщеплены на подоболочки, поэтому орбитальное квантовое число также характеризует энергетические подуровни в электронной оболочке атома.
Орбитальные квантовые числа принимают целочисловое значение от 0 до (n-1). Подоболочки также обозначаются буквами:
Подоболочка (подуровень)…………………s p d f
Орбитальное квантовое число, l ……………0 1 2 3
Электроны с орбитальным квантовым числом 0, называются s - электронами. Орбитали и соответственно электронные облака имеют сферическую форму (рис. 1.2).
Электроны с орбитальным квантовым числом 1называются p - электронами. Орбитали и соответственно электронные облака имеют форму, напоминающую гантель (рис. 1.2).
Электроны с орбитальным квантовым числом 2 называют d – электронами. Орбитали имеют форму четырехлепестковой розетки (рис. 1.2).
Электроны с орбитальным квантовым числом 3 получили название f – электронов. Форма их орбиталей еще сложнее, чем форма d – орбиталей.
В первой оболочке (n=1) может быть одна (s–), во второй (n=2) две (s- и p-), в третьей (n=3) – три (s-, p-, d-), в четвертой (n=4) – четыре (s-, p-, d-, f-)-подоболочки.
Магнитное квантовое число ml характеризует положение орбитали в пространстве (см. рис. 1.2).
 Рис. 1.2. Фрмы электронных облаков различных атомных орбиталей Рис. 1.2. Фрмы электронных облаков различных атомных орбиталей | В отсутствие внешнего магнитного поля все орбитали одного подуровня (подоболочки) имеют одинаковое значение энергии. Под воздействием внешнего магнитного поля происходит расщепление энергии подоболочек. Магнитное квантовое число принимает целочисленные значения от –l до +l, включая ноль. Например, для l = 3, магнитные квантовые числа имеют значения -3, -2, -1, 0, +1, +2, +3. Таким образом, в данной подоболочке (f-подоболочке) существует семь орбиталей. |
Соответственно в подоболочке s (l = 0) имеется одна орбиталь (ml = 0), в подоболочке р (l = 1) – три орбитали (ml = -1, 0, +1), в подоболочке d (l = 2) пять орбиталей (ml = -2, -1, 0, +1, +2).
Атомная орбиталь. Каждая электронная орбиталь в атоме (атомная орбиталь, АО) может характеризоваться тремя квантовыми числами n, l и ml.
Условно атомную орбиталь обозначают в виде клеточки  .
.
Соответственно для s-подоболочки имеется одна АО  , для р-подоболочки – три АО
, для р-подоболочки – три АО 

 , для d-подоболочки – пять АО
, для d-подоболочки – пять АО 



 , для f-подоболочки – семь АО
, для f-подоболочки – семь АО 





 .
.
Спиновое квантовое число  . Каждый электрон характеризуется собственным механическим моментом движения, который получил название спина. Соответствующие спину квантовое число имеет только 2 значения: +1/2 и -1/2. Положительные и отрицательные значения спина связаны с его направлением. Электроны с разными спинами обычно обозначаются противопложно напрвленными стрелками
. Каждый электрон характеризуется собственным механическим моментом движения, который получил название спина. Соответствующие спину квантовое число имеет только 2 значения: +1/2 и -1/2. Положительные и отрицательные значения спина связаны с его направлением. Электроны с разными спинами обычно обозначаются противопложно напрвленными стрелками 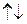 .
.
 2020-04-12
2020-04-12 823
823








