Электролизом называют процессы, происходящие на электродах под действием электрического тока, подаваемого от внешнего источника.
При электролизе происходит превращение электрической энергии в химическую.
| Ячейка для электролиза, называемая электролизером, состоит из двух электродов и электролита (рис. 6.3). Электрод, на котором идет реакция восстановления (катод), у электролизера подключен к отрицательному полюсу внешнего источника тока. Электрод, на котором протекает реакция окисления (анод), подключен к положительному полюсу источника тока. Рассмотрим электродные реакции на примере электролиза расплава хлорида натрия. |  Рис. 6.3. Схема электролиза расплава NaCl
Рис. 6.3. Схема электролиза расплава NaCl
|
При плавлении происходит термохимическая диссоциация соли:
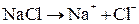 .
.
Если погрузить инертные (угольные) электроды и пропускать постоянный электрический ток, то ионы будут двигаться к электродам: катионы Na+ – к катоду, анионы Cl- – к аноду (рис. 6.3.). В итоге на катоде выделяется металлический натрий, а на аноде – хлор:

 2 восстановление
2 восстановление
 1 окисление
1 окисление


 2020-04-12
2020-04-12 118
118








