13. Закон действующих масс для гомогенной реакции: аА + вВ → сАВ будет иметь вид:
а) u = k [A]a; б) u = k[A]a · [B]в; в) u = k[B]в; г) u = [A]a · [B]в.
1. Изолированной термодинамической системой называется:
а) система, которая обменивается с окружающей средой только энергией;
б) система, которая обменивается с окружающей средой, только массой;
в) система, которая обменивается с окружающей средой и массой и энергией;
г) система, которая не обменивается с окружающей средой массой и энергией.
6. Энтропия системы при самопроизвольных процессах всегда должна быть:
а) DS >0; б) DS < 0; в) DS = 0; г) 0< DS < 1.
7. Если ∆ Н растворения не изменяется - это процесс:
а) эндотермический; б) экзотермически;, в) изотермический; г) изохорный.
8. Теплотой сгорания данного вещества (∆ Н) называют:
а) тепловой эффект сгорания одной молекулы вещества;
б) тепловой эффект сгорания 1 моль вещества;
в) тепловой эффект сгорания 1 г вещества;
г) тепловой эффект сгорания 1 л вещества.
13. Математическая запись закона действующих масс для реакции 2 Znтв+ O2 (г) → 2ZnO это:
а) u = k [Zn]2; б) u = k [Zn]2 · [O2]; в) u= k[O2]; г) k = [Zn]2 · [O2].
4. Закрытой термодинамической системой называется:
а) система, которая обменивается с окружающей средой только энергией;
б) система, которая обменивается с окружающей средой, только массой;
в) система, которая обменивается с окружающей средой и массой и энергией;
г) система, которая не обменивается с окружающей средой массой и энергией.
5. I закон термодинамики имеет математическое выражение:
а ) DG=DH-TDS; б) DU=Q-pDV; в) DF=DU-TDS; г) DU=Q+pDV
6. Самопроизвольно будут протекать реакции, для которых будет:
а) DH > 0, б) DН < 0, в) DН = 0; г) 0< DН < 1.
7. Закон действующих масс применим к:
а) обратимым реакциям; б) реакциям необратимым;
в) реакциям окислительно-восстановительным; г) реакциям обмена
10. Константа равновесия не зависит от:
а) температуры; б) природы растворенного вещества; в) концентрации; д) природы растворителя.
11. Выражение для константы равновесия реакции N2 + 3H2 ↔ 2NH3 будет иметь вид:
а) 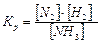 , б)
, б)  , в)
, в)  ; г) Кр= [N2][H2]3[NH3]2
; г) Кр= [N2][H2]3[NH3]2
2. Какое утверждение неверно для определения функций состояния:
а) функции состояния определяются разницей конечного и начального состояния системы;
б) значения функций состояния не зависят от предистории системы при переходе из исходного в конечное состояние;
в) функции состояния зависят от предистории системы при переходе из исходного в конечное состояние;
 2020-04-12
2020-04-12 464
464








