5. II закон термодинамики для изобарно-изотермических условий имеет математическое выражение:
а ) DG=DH-TDS; б) DU=Q-pDV; в) DF=DU-TDS; г) DU=Q+pDV.
6. При низких температурах самопроизвольно будут протекать реакции, для которых будет:
а) DH > 0, б) DН < 0, в) DН = 0; г) 0< DН < 1.
7. Согласно закону действующих масс скорость реакции:
а) обратно пропорцианальна произведению концентраций исходных веществ;
б) прямо пропорцианальна произведению концентраций исходных веществ;
в) прямо пропорцианальна произведению концентраций продуктов реакций;
г) обратно пропорцианальна произведению концентраций продуктов реакции.
10. Константа равновесия для самопроизвольного процесса должна быть:
а) Kр> 1; б) Кр < 1; в) Кр = 1; г) 0< Кр < 1.
11. Выражение для константы равновесия реакции Cl2 + H2 ↔ 2HCl будет иметь вид:
а)  , б)
, б) 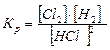 , в)
, в)  ; г) Кр= [СL2][H2][HCl]2
; г) Кр= [СL2][H2][HCl]2
ОВР
13. В окислительно-восстановительных реакциях окислитель:
а) отдает электроны; б) принимает электроны;
В) нет процесса приема и отдачи электронов; г) и принимает и отдает электроны
12. ЭДС гальванического элемента равна: а) сумме электродных потенциалов;
б) разности электродных потенциалов;
в) величине потенциала положительного электрода;
г) величине потенциала отрицательного электрода.
12. Окислителем называется вещество (или частица), которая:
а) отдает электроны; б) принимает электроны;
в) переносит электроны; г) отдает и принимает электроны.
13. ЭДС для самопроизвольно протекающей ОВР должна быть: а) e > 0; б) e < 0; в) e = 0; г) 0< e < 1
9. Электродный потенциал обозначается: а) j; б) y; в) u; г) n.
12. Окислитель имеет значение электродного потенциала: а) j < 0; б) j > 0; в) j = 0; г) 0 < j <1.
13. ЭДС для самопроизвольно протекающей ОВР должна быть: а) e > 0, б) e < 0, в) 0 < e <1; г) e = 0.
D-Элементы
Cr, Mn
1. Продуктами при взаимодействии MnО2 с серной кислотой будут:
а) Mn(SO4)2, H2O; б) MnSO4, O2, H2O; в) MnSO4, H2; г) Mn(SO4)2, O2, H2O.
2. Продуктами при взаимодействии Cr с раствором едкого калия будут:
а) Сr(OH)3, O2, K2O; б) KCrO2, H2; в) KCrO2, H2O; г) K3[Сr(OH)6], H2.
3. Формулы продуктов, которые образуются при термическом разложении перманганата калия,- это:
а) KMnO4, MnO2, O2; б) K2MnO4, MnO, O2; в) KMnO4, MnO, O2; г) K2MnO4, MnO2, O2.
4. С едким натром не будет взаимодействовать:
а) MnO4; б) CrO; в) Cr2O3; г) Mn2O7.
5. При термолизе перманганата калия степень окисления марганца в исходном веществе и продуктах равна соответственно):
а) +6 и + 7; +4; б) +6 и + 7; +2; в) +7 и + 6; +4; г) +7 и + 6; 0.
6. С соляной кислотой не будет взаимодействовать:
а) MnO; б) CrO; в) CrO3; г) Cr2O3.
7. С концентрированной азотной кислотой не реагирует:
а) CrO3; б) CrO; в) Cr2O3; г) MnO.
8. Продуктами при взаимодействии Mn с разбавленной серной кислотой будут:
а) Mn(SO4)2, SO2, H2O; б) MnSO4, SO2, H2O;
в) MnSO4, H2; г) Mn(SO4)2, H2.
9. С концентрированной азотной кислотой при обычных условиях не реагирует:
а) Zn; б) Cu; в) Ca; г) Cr.
10. Продуктами при взаимодействии Cr с концентрированной серной кислотой будут:
а) Сr2(SO4)3, SO2, H2O; б) CrSO4, SO2, H2O; в) CrSO4, H2; г) Сr2(SO4)3, H2.
Fe, Co, Ni
1. Восстановительные свойства уменьшаются в ряду:
а) Fe®Co®Ni; б) Ni®Co®Fe; в) Co®Fe®Ni; г) Fe®Ni®Co.
2. Гидроксид железа (II) и ион Fe3+ обладают:
а) амфотерными и окислительно-восстановительными свойствами;
б) основными и восстановительными свойствами;
в) основными и окислительными свойствами;
г) кислотными и восстановительными свойствами.
3. Гидроксид железа образуется при взаимодействии:
а) FeCl3 + NaOHнедостаток®; в) Fe2O3 + H2O®;
б) FeCl3 + NaOHизб.®; г) FeCO3 + H2O (горячая)®.
4. Оксид кобальта (III) и ион Co3+ обладают:
а) основными и окислительно-восстановительными свойствами;
б) кислотными и окислительными свойствами;
в) амфотерными и окислительными свойствами;
г) основными и окислительными свойствами.
5. Не возможно взаимодействие:
а) FeCl3 + HNO3®; в) FeCl3 + H2O®;
б) FeSO4 + NaOH®; г) Fe(NO3)3 + Na2S®.
6. Гидроксид кобальта (II) и ион Co2+ обладают:
а) основными и окислительно-восстановительными свойствами;
б) кислотными и окислительными свойствами;
в) амфотерными и окислительно-восстановительными свойствами;
г) основными и восстановительными свойствами.
7. С концентрированной азотной кислотой при обычных условиях не реагирует:
а) Zn; б) Cu; в) Ca; г) Fe.
8. Гидроксид никеля (II) и ион Ni2+ обладают:
а) основными и окислительными свойствами;
б) основными и восстановительными свойствами;
в) амфотерными и окислительно-восстановительными свойствами;
г) кислотными и восстановительными свойствами.
9. Продуктами при взаимодействии Fe с раствором едкого натра будут:
а) Fe(OH)3, O2, Na2O; б) Na3[Fe(OH)6], H2;
в) Na3FeO3, H2O; г) Na3FeO3, H2.
10. Гидроксид никеля (III) и ион Ni3+ обладают:
а) амфотерными и окислительно-восстановительными свойствами;
б) основными и восстановительными свойствами;
в) амфотерными и окислительными свойствами;
г) кислотными и восстановительными свойствами.
Cu, Ag, Au
1. Соль, которая не подвергается гидролизу - это:
а) AgNO3; б) Cu(NO3)2; в) AuCl3; г) СuCl2.
2. Продуктами при взаимодействии золота с “царской водкой будут”:
а) H[AuCl4], NO, H2; б) H[AuCl4], NO, H2O;
в) AuCl3, NO, H2O; г) H[AuCl4], O2, H2O.
3. Для Cu2O невозможно взаимодействие:
а) Cu2O + HCl®; в) Cu2O + HNO3 ®;
б) Cu2O + NH3®; г) Cu2O + NaOH ®.
4. Явление “провала электрона” наблюдается у:
а) Ni; б) Au; в) Hg; г) Zn.
5. При термическом разложении нитрата серебра окислителями являются:
а) только азот; б) азот и кислород;
в) серебро и кислород; г) азот и серебро.
6. При пропускании водорода над раскаленной медной проволокой образуются:
а) Сu, H2O; б) Сu, O2, H2O; в) Сu2O, H2O; г) Сu, H2O2.
7. С разбавленной серной кислотой взаимодействовать будет:
а) Au; б) Co; в) Ag; г) Cu.
8. Формулы продуктов, которые образуются при термическом разложении нитрата меди,- это:
а) Сu, NO, O2; б) Сu, NO2, O2; в) СuO, NO, O2; г) СuO, NO2, O2.
9. Оксид серебра не реагирует с:
а) HNO3; б) KOH; в) H2SO4; г) NH3.
10. Гидроксид меди (II) не получится при взаимодействии:
а) CuSO4 + NaOHнедостаток®; в) CuSO4 + NH3(р-р) ®;
б) Cu(NO3)2 + Ba(OH)2®; г) СuCO3 + H2O(горячая)®.
11. Формулы продуктов, которые образуются при термическом разложении нитрата серебра,- это:
а) Ag, NO2, O2; б) Ag2O, NO2, O2; в) Ag, NO, O2; г) Ag2O, NO, O2.
12. Для Au2O3 невозможно взаимодействие:
а) Au2O3 + NaOH®; в) Au2O3 + HNO3 ®;
б) Au2O3 + HCl ®; г) Au2O3 + H2O®.
13. Не может протекать реакция:
а) Ag + HNO3®; в) AuCl3 + NaOH ®;
б) Cu(NO3)2 + HCl®; г) AgNO3 + NH3(р-р) ®.
14. Золото не будет растворяться в:
а) HNO3; б) KCN + O2; в) HNO3 + 4HCl; г) Hg.
15. Для CuO невозможно взаимодействие:
а) CuO + NaOH(изб, конц.)®; в) CuO + HNO3 ®;
б) CuO + NH3®; г) CuO + H2O®.
Zn, Cd, Hg
1. Оксидной пленкой на воздухе не покрывается:
а) Zn; б) Ca; в) Hg; г) Cd.
2. Основными свойствами обладает:
а) HgО; б) ZnO; в) Zn(OH)2; г) Al2O3.
3. Не может протекать реакция:
а) Zn + HNO3®; в) HgO ® (нагревание);
б) Cd(NO3)2 + HCl®; г) ZnCl2 + NaOH ®.
4. С соляной кислотой не будет взаимодействовать:
а) Zn; б) Cd; в) Hg; г) Ba.
5. При взаимодействии цинка со щелочью образуются:
а) ZnO, NaH; б) Na2[Zn(OH)4], H2;
в) Na2[Zn(OH)4], O2; г) Na2ZnO2, H2O.
6. Формула сулемы – сильного ядовитого вещества – это:
а) Hg2Cl2; б) HgSO4; в) HgCl; г) HgCl2.
7. Степень окисления +1 встречается у:
а) Zn; б) Cd; в) Hg; г) Ba.
8. Кадмий не реагирует с:
а) едким кали; б) разбавленной серной кислотой;
в) азотной кислотой; г) кислородом.
9. Невозможно взаимодействие:
а) Cd(OH)2 + HNO3®; б) Hg(NO3)2 + Na2S ®; в) ZnO + NaOH®; г) Hg(NO3)2 + HCl®.
10. С разбавленной серной кислотой не будет взаимодействовать:
а) Zn; б) Hg; в) Cd; г) Co.
11. При сплавлении оксида цинка со щелочью образуются:
а) Na2ZnO2, H2O. О2; б) Na2[Zn(OH)4], H2;
в) Na2ZnO2, H2O; г) Na2ZnO2, H2.
12. Формула каломели – это:
а) Hg2Cl2; б) HgSO4; в) HgCl; г) HgCl2.
13. Ртуть при взаимодействии с концентрированной серной кислотой образует:
а) Hg2SO4, SO2, H2O; б) HgSO4, H2; в) HgSO4, SO2, H2O; г) HgSO4, S, H2O.
14. Амфотерными свойствами обладает:
а) HgО; б) ZnO; в) CdO; г) Hg2O.
15. Ртуть образуется при термическом разложении соли:
а) HgNO3; б) HgSO4; в) HgS; г) HgCl2.
 2020-04-12
2020-04-12 580
580








