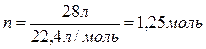Методические указания к самостоятельным работам
И контрольным заданиям по неорганической химии.
Тюмень
2020
Сборник адаптированных конспектов по учебной дисциплины «Химия» разработан в соответствии с «Рекомендациями по организации получения основного общего образования в пределах освоения образовательных программ СПО на базе основного общего образования с учетом требований Федеральных государственных образовательных стандартов и получаемой профессии или специальности среднего профессионального образования» и Примерной программой, рекомендованной ФГАУ «ФИРО» 21 июля 2015 г, по специальности 35.02.04- Технология комплексной переработки древесины, 15.02.14. – Оснащение средствами автоматизации технологических процессов и производств (по отраслям), 13.02.11 – Техническая эксплуатация и обслуживание электрического и электромеханического оборудования (по отраслям), 23.02.04. – Техническая эксплуатация подъемно-транспортных, строительных, дорожных машин и оборудования (по отраслям), 08.01.24 – «Мастер столярно-плотничных, паркетных и стекольных работ», 35.02.12 – Садово-парковое и ландшафтное строительство. 08.02.05.Строительство и эксплуатация автомобильных дорог и аэродромов. 08.02.09. – Монтаж, накладка и эксплуатация электрооборудования промышленных и гражданских зданий. 35.02.01. – Лесное и лесопарковое хозяйство», 25.02.08.Эксплуатация беспилотных авиационных систем.
Организация–разработчик: государственное автономное профессиональное образовательное учреждение Тюменской области «Тюменский колледж производственных и социальных технологий».
Разработчик:
Солодовникова Н. С., преподаватель
Рассмотрена ПЦК «Технология деревообработки».
Протокол №____________ от «____»__________20___г.
Председатель ПЦК
_________________Быкова Е.Л.
СОДЕРЖАНИЕ
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА ………………………………………………..4
ТЕМА 1 ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ……………………………………5
ТЕМА 2 ОСНОВНЫЕ ЗАКОНЫ ХИМИИ……………………………………..9
ТЕМА 3 ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА Д.И. МЕНДЕЛЕЕВА. СТРОЕНИЕ АТОМА…………………………………..18
ТЕМА 4 ХИМИЧЕСКАЯ СВЯЗЬ………………………………………………21
ТЕМА 5 ОБМЕНА……………………………………………………………..24
ТЕМА 6 РАСТВОРЫ. МАССОВАЯ ДОЛЯ РАСТВОРЕННОГО
ВЕЩЕСТВА……………………………………………………………………...27
ТЕМА 7 СТЕПЕНЬ ОКИСЛЕНИЯ. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ………………………………………...30
ТЕМА 8 КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ………………….34
ЛИТЕРАТУРА……………………………………………………………….......40
ПРИЛОЖЕНИЯ………………………………………………………………….41
Растворимость оснований, кислот и солей в воде……………………………..42
Периодическая система химических элементов Д.И. Менделеева…………..43
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Химия является одной из фундаментальных естественно – научных дисциплин. В настоящее время большое значение придается практической направленности обучения. Умение применять теоретические знания при решении задач и выполнении упражнений является одним из определяющих факторов при оценке уровня знаний обучающихся. Решение задач и выполнение упражнений позволяет:
· расширять кругозор обучающихся;
· развивать умение логически мыслить;
· воспитывать самостоятельность, внимательность, умение анализировать, делать правильные выводы;
· устанавливать связь химии с другими науками: физикой, математикой;
· способствует подготовиться к успешной аттестации по предмету.
Умение решать задачи и выполнять упражнения по химии является основным критерием творческого усвоения дисциплин. Это эффективный способ проверки знаний и важное средство их закрепления.
Методические указания и контрольные задания состоят из 8 тем. В каждой теме изложены основные понятия и теоретические аспекты, приведены примеры решения задач и выполнения упражнений, а также контрольные задания.
Для организации самостоятельной работы обучающихся в каждой теме предложено 30 вариантов контрольных заданий.
К контрольным заданиям по темам: «Основные понятия химии», «Основные законы химии», «Растворы. Массовая доля растворенного вещества» указаны ответы, что позволяет оценить вероятность и достоверность ответа, полученного в результате решения задачи.
Порядок выполнения заданий и варианты определяет учитель в зависимости от уровня полученных знаний 8-11 класс. Задания могут выполняться либо на учебном занятии, либо при подготовке домашнего задания.
Каждое задание должно быть аккуратно оформлено: указан номер контрольного задания, вариант, переписано условие задания, записаны необходимые формулы и дан четкий ответ. При решении задачи нужно приводить все математические преобразования, избирая простейший путь решения или опираться на предложенный алгоритм.
При выполнении заданий следует пользоваться Периодической системой элементов Д.И. Менделеева, таблицей растворимости оснований, кислот, солей.
ТЕМА 1 ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
Молекула - наименьшая частица вещества, обладающая его химическими свойствами.
Атом – электронейтральная, химически неделимая частица вещества.
Атом - наименьшая частица химического элемента, сохраняющая все его химические свойства. Различным элементам соответствуют различные атомы.
Химический элемент – это определенный вид атомов, с одинаковым положительным зарядом ядра.
Относительная атомная масса (Аr) – величина, равная отношению средней массы атома естественного изотопического состава элемента к 1/12 массы атома углерода 12С. Значения относительных атомных масс приведены в периодической системе Д.И. Менделеева.
Относительная молекулярная масса (Мr) – величина, равная отношению средней массы молекулы естественного изотопического состава вещества к 1/12 массы атома углерода 12С. Значения относительных атомных масс приведены в периодической системе Д.И. Менделеева. Относительная молекулярная масса числено, равна сумме относительных масс всех атомов, входящих в молекулу. Например, Мr(Н2О) = Аr(H) · 2 + Аr(O) = 1· 2 +16 = 18
Моль (n) – количество вещества, содержащее столько структурных единиц (молекул, атомов, ионов, электронов и др), сколько атомов содержится в 0,012 кг изотопа углерода 12С.
Молярная масса (М) – величина, равная отношению массы вещества (m) к количеству вещества (n).
Молярный объем (Vm) – это отношение объема газообразного вещества к количеству вещества.
При нормальных условиях 1 моль любого газа равен Vm = 22,4 л/моль
Примеры решения задач
Задача 1. Вычислить массу метана количеством вещества 0,1 моль.
| Дано: n(CН4) = 0,1 моль | Решение: 1) для определения массы преобразовать формулу: 2) по таблице Д.И. Менделеева вычислить относительную молекулярную массу метана CН4 Mr(CН4) = Аr(С) + Аr(Н)∙4 = 12+1∙4 = 16 Mr = М, Молярная масса M(CН4) = 16 г/моль 3) по формуле (2) вычислить массу СН4 m(CН4) = 0,1моль ∙16 г/моль = 1,6 г 4) записать ответ Ответ: m(CН4) = 1,6 г |
| Найти: m(CН4) =? г |
Задача 2. Вычислить объем углекислого газа при н.у., взятого количеством вещества 3 моль.
| Дано: n(CО2) = 3 моль | Решение: 1) для определения массы преобразовать формулу:
Vm = 22,4 л/моль при н.у. 2) по формуле (2) вычислить объем углекислого газа: V = 3моль ∙ 22,4 л/моль = 67,2 л. 3) записать ответ: Ответ: V(CО2) = 67,2 л. |
| Найти: V(CО2) =? г |
Задача 3. Вычислить массу углекислого газа, занимающего при н.у. объем 28 л.
| Дано: V(CО2) = 28 л | Решение: 1) для определения массы преобразовать формулу: 2) вычислить количество вещества СО2 по известному объему, используя формулу:
3) по формуле (2) вычислить массу углекислого газа: m(CO2) = 1,25 моль ∙ 44г/моль =55г 4) записать ответ: Ответ: m(CО2) = 55 г. |
| Найти: m(CО2) =? |
 2020-04-12
2020-04-12 128
128
 (1), отсюда m = n ∙ M (2)
(1), отсюда m = n ∙ M (2)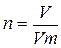 (1), отсюда V = n ∙ Vm (2)
(1), отсюда V = n ∙ Vm (2)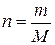 (1), отсюда m = n ∙ M (2)
(1), отсюда m = n ∙ M (2) , Vm = 22,4 л/моль при н.у.
, Vm = 22,4 л/моль при н.у.