Основной закон массопередачи скорость процесса равна движущей силе, деленной на сопротивление, т.е.:
 , ,
| (5.1) |
где dm – количество вещества, перешедшего из одной фазы в другую; dF – поверхность фазового контакта; dτ – время; ∆ - движущая сила массообмена ( или
или  ); R – сопротивление.
); R – сопротивление.
Если вместо R взять обратную величину k коэффициент массопередачи β будет иметь вид:

| (5.2) |
Или
 , ,
| (5.3) |
где β– коэффициент массопередачи;  - движущая сила массообмена по фазе L;
- движущая сила массообмена по фазе L;  - движущая сила моссобмена по фазе G.
- движущая сила моссобмена по фазе G.
когда dm отнесено к единице времени, уравнение (5.2) и (5.3) принимает вид:

| (5.4) |
Или
 . .
| (5.5) |
Далее слайд 5.3:
На рис. 5.1 приведены варианты выражения движущей силы диффузионных процессов.

| 
|

| 
|
| Рис. 5.1. Выражения движущей силы диффузионных процессов: | |
Как видно из приведенных рисунков движущая сила меняется с изменением рабочих концентраций, поэтому для всего процесса массообмена, протекающего в пределах изменения концентраций от начальных до конечных должна быть определена средняя движущая сила ( ).
).
Далее слайд 5.4:
основное уравнение массопередачи для всех поверхностей контакта фаз может быть записано в виде:
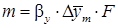
| (5.6) |
Или
 . .
| (5.7) |
могут встретиться два случая:
1. Зависимость между равновесными концентрациями не линейна; т.е.  ;
;
2. Зависимость между равновесными концентрациями линейна, т.е.  (где А – постоянная величина).
(где А – постоянная величина).
С учетом средней движущей силы процесса основное уравнение массопередачи для всех поверхностей контакта фаз может быть записано в виде:
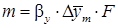
| (5.6) |
или
 . .
| (5.7) |
При определении средней движущей силы могут встретиться два случая:
1. Зависимость между равновесными концентрациями не линейна; для этого случая равновесная концентрация определяется общей функциональной зависимостью  ;
;
2. Зависимость между равновесными концентрациями линейна, т.е.  (где А – постоянная величина).
(где А – постоянная величина).
В аппаратуре, используемой для проведения массообменных процессов, равновесные концентрации распределяемого вещества иногда не достигается.
Действительные концентрации распределяемого вещества, или рабочие концентрации, всегда отличаются от равновесных. Разность между этими концентрациями, характеризующая степень отклонения от равновесия и представляет собой движущую силу массообменного процесса.
Материальный баланс. Материальный баланс массообменных (диффузионных) процессов в общем виде может быть составлен на основе следующих рассуждений. Обозначим массовые скорости распределяющих фаз вдоль поверхности их раздела, выраженные в килограммах инертного вещества в час, через G и L, а концентрации распределяемого вещества соответственно  кг/кг инертного вещества и
кг/кг инертного вещества и  кг/кг инертного вещества.
кг/кг инертного вещества.
При  >
>  и отсутствии потерь в процессе взаимодействия фаз при параллельных потоках вдоль поверхности раздела величина
и отсутствии потерь в процессе взаимодействия фаз при параллельных потоках вдоль поверхности раздела величина  уменьшается, а
уменьшается, а  увеличивается (рис. 5.2).
увеличивается (рис. 5.2).
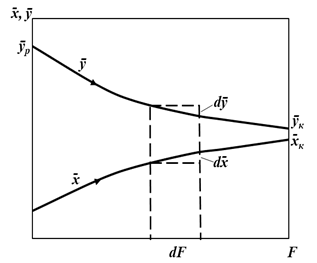
| 
|
| Рис. 5.2. К выводу уравнения рабочей линии | Рис. 5.3. Рабочая линия процесса |
Для элемента поверхности dF имеем:
 . .
| (5.8) |
Интегрируя уравнения (5.8) в пределах от начальных до конечных концентраций  и
и  , получим:
, получим:
 . .
| (5.9) |
Из уравнения (5.9) получим соотношения между массовыми потоками распределяющих фаз:
 , ,
| (5.10) |
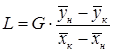 . .
| (5.11) |
Интегрируя уравнение (5.8) в пределах от начальных концентраций до текущих  и
и  , получим:
, получим:
 . .
| (5.12) |
Откуда

| (5.13) |
или
 , ,
| (5.14) |
где  - удельный расход одной из распределяющих фаз.
- удельный расход одной из распределяющих фаз.
Аналогично для противоточного взаимодействия фаз можно получить уравнение:
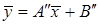 , ,
| (5.15) |
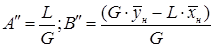 . .
| (5.16) |
Из уравнений (5.14) и (5.15) следует, что концентрации распределяемого вещества в фазах G и L связаны линейной зависимостью. Поэтому удобно процессы массообмена представлять графически в координатах  (Рис. 5.3), т.е. в виде зависимости между так называемыми рабочими концентрациями. Уравнение прямой, выражающее зависимость между рабочими концентрациями, называют рабочей линией процесса.
(Рис. 5.3), т.е. в виде зависимости между так называемыми рабочими концентрациями. Уравнение прямой, выражающее зависимость между рабочими концентрациями, называют рабочей линией процесса.
Энергетический баланс. В основу энергетического баланса массообменных процессов также положен закон сохранения энергии:
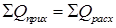 . .
| (5.17) |
Тепловой баланс составляют по данным материального баланса с учетом физических превращений, протекающих в аппарате, а также с учетом подвода или отвода тепла
 , ,
| (5.18) |
где  - тепло вносимое в аппарат и выносимое из него с взаимодействующими фазами;
- тепло вносимое в аппарат и выносимое из него с взаимодействующими фазами; 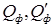 - тепло, выделяемое и поглощаемое в результате фазовых переходов;
- тепло, выделяемое и поглощаемое в результате фазовых переходов;  - тепло подводимое в аппарат и выводимое из аппарата через теплообменные устройства;
- тепло подводимое в аппарат и выводимое из аппарата через теплообменные устройства;  - тепловые потери в окружающую среду (5% от прихода).
- тепловые потери в окружающую среду (5% от прихода).
Полученное уравнение теплового баланса (5.18) может принимать различную форму в зависимости от типа массообменного процесса в связи с чем, некоторые из приведенных статей прихода (или расхода) в уравнении теплового баланса могут отсутствовать.
Процессы абсорбции.
В химической технологии различают физическую абсорбцию и хемосорбцию. При физической абсорбции растворение газа не сопровождается химической реакцией. При хемосорбции абсорбируемый компонент вступает в химическую реакцию в жидкой фазе.
Примерами использования процессов абсорбции в технике могут служить разделение углеводородных газов на нефтеперерабатывающих установках, получение соляной кислоты, получение аммиачной воды, очистка отходящих газов с целью улавливания ценных продуктов или обезвреживание выбросов вредных (загрязняющих) веществ и др.
 2020-04-12
2020-04-12 212
212

 -равновесная и текущая концентрации вещества в фазе G;
-равновесная и текущая концентрации вещества в фазе G;  -равновесная и текущая концентрации вещества в фазе L.
-равновесная и текущая концентрации вещества в фазе L.






