При большой разнице температур между 298 и Т, необходимо учитывать вид температурной зависимости  , которая в технической и справочной литературе дается в виде температурного ряда, например:
, которая в технической и справочной литературе дается в виде температурного ряда, например:
- для органических соединений
 , ,
| (1.33) |
- для неорганических соединений
 . .
| (1.34) |
Однако в результате химической реакции меняется теплоемкость участников реакции, тогда:
 , ,
| (1.35) |
где Δа, Δв, Δс – разность сумм соответствующих коэффициентов в  продуктов реакции и исходных веществ с учетом их стехиометрических коэффициентов.
продуктов реакции и исходных веществ с учетом их стехиометрических коэффициентов.
Подставив уравнение (1.35) в (1.31), например, для органических соединений получим:
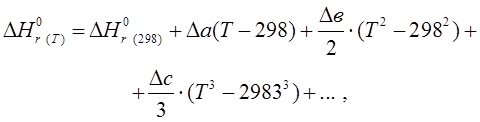
| (1.36) |
Слайд№22 до, далее Слайд№23.
В большинстве случаев для диапазона температур, не превышающего 100 К линейная интерполяция теплоемкостей веществ допускается.
Количество тепла, выделяемого или поглощаемого в химической реакции, можно определить по уравнению:

| (1.37) |
Или
 , ,
| (1.38) |
где nj – количество (в молях) образовавшегося продукта; ni,0 – количество (в молях) реагента; xi – степень конверсии реагента.
Основной целью расчета теплового баланса является определение тепла необходимого для нагревания и охлаждения аппарата QF. Например, для реакции
А + В = С + D – Qp

| (1.39) |
Или
 , ,
| (1.40) |
где  – конвективный перенос тепла. Слайд№23 до, далее Слайд№24.
– конвективный перенос тепла. Слайд№23 до, далее Слайд№24.
Зная QF можно рассчитать необходимую поверхность теплообмена при заданном времени охлаждения или нагревания, или времени охлаждения (нагревания) при заданной поверхности в периодических процессах.
В обоих случаях исходят из общеизвестного уравнения теплопередачи:
· для периодических процессов
 , ,
| (1.41) |
· для непрерывных процессов
 . .
| (1.42) |
В этом уравнении QF – количество передаваемого тепла; К – коэффициент теплопередачи; F – поверхность теплообмена; Δt – средняя разность температур между реакционной массой и теплоносителем (хладагентом); τ – время проведения процесса.
Если возникает необходимость определения тепла на нагрев реакционной массы перед началом процесса или охлаждения ее в конце процесса, то для этих целей используют уравнение:
 , ,
| (1.43) |
где m – масса веществ, входящих в состав реакционной массы;  - теплоемкость отдельных веществ; Tк и Tн – конечная и начальная температуры реакционной смеси.
- теплоемкость отдельных веществ; Tк и Tн – конечная и начальная температуры реакционной смеси.
Слайд№24 до, далее Слайд№25.
Как уже отмечалось, энергетические расчеты предполагают также расчет расходов теплоносителей для обогрева реакционной массы или хладагентов для ее охлаждения.
В качестве теплоносителей наиболее широко используется пар. Расход пара можно определить по уравнению:
 , ,
| (1.44) |
где Q – расход тепла, кДж; y – теплосодержание пара, кДж/кг; t – температура конденсата, которую можно принять равной температуре пара, численно равная теплосодержанию конденсата в кДж/кг.
Наиболее распространенными охлаждающими агентами являются вода, рассол, воздух. Расход охлаждающих агентов определяется по формуле:
 , ,
| (1.45) |
где Q – количество тепла, которое надо отвести, кДж;  - теплоемкость охлаждающего агента; tк и tн – конечная и начальная температура хладагента, °С.
- теплоемкость охлаждающего агента; tк и tн – конечная и начальная температура хладагента, °С.
 2020-04-12
2020-04-12 80
80








