Дифференциальная форма первого закона термодинамики выглядит так
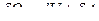 (3)
(3)
Количество теплоты 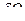 , сообщенное системе, расходуется на увеличение ее внутренней энергии
, сообщенное системе, расходуется на увеличение ее внутренней энергии  и на совершение работы
и на совершение работы  против внешних сил.
против внешних сил.
Символы 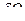 и
и  означают элементарное количество теплоты и работы. Ни теплота, ни работа не являются функциями состояния и зависят от вида процесса.
означают элементарное количество теплоты и работы. Ни теплота, ни работа не являются функциями состояния и зависят от вида процесса.
Элементарное количество теплоты, подведенное к системе, может быть определено по формуле
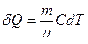 (4)
(4)
Элементарная работа, совершаемая системой, вычисляется из выражения
 , (5)
, (5)
где р – давление;
dV – бесконечно малое изменение объема.
Полной внутренней энергией 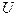 данной системы называется энергия движения и взаимодействия микрочастиц (молекул, атомов, электронов и т.п.) этой системы. В термодинамике важна не сама энергия, а ее изменение
данной системы называется энергия движения и взаимодействия микрочастиц (молекул, атомов, электронов и т.п.) этой системы. В термодинамике важна не сама энергия, а ее изменение
при переходе из одного состояния в другое. Поэтому под внутренней энергии ей системы будем понимать только энергию теплового движения частиц вещества (кинетическую энергию поступательного, вращательного и колебательного движения молекул) и взаимно потенциальную энергию (обусловленную силами межмолекулярного взаимодействия). Так как внутренняя энергия системы зависит только от состояния этой системы (например, V и T), то  является полным дифференциалом.
является полным дифференциалом.
Применение первого закона термодинамики к процессам идеального газа
Идеальным называется газ, который удовлетворяет следующим условиям:
1. Силы взаимодействия между молекулами отсутствуют;
2. Собственный объем молекул газа мал по сравнению с объемом сосуда, содержащим газ.
3. Столкновение молекул газа между собой и стенками сосуда являются абсолютно упругими ударами.
Состояние идеального газа описывается уравнением Менделеева-Клапейрона
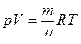 (6)
(6)
Ввиду отсутствия сил взаимодействия между молекулами идеального газа его внутренняя энергия представляет собой только кинетическую энергию хаотического движения молекул. Она зависит только от температуры и не зависит от объема.
Изопроцессом называется процесс, происходящий при одном постоянном параметре.
1. Изохорический процесс происходит при постоянном объеме V =const.
Первый закон термодинамики для изохорического процесса выглядит так
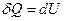 (7)
(7)
так как
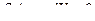 (8)
(8)
т.е. газ не совершает работы, и все тепло, сообщенное ему, идет только на увеличение его внутренней энергии.
 2020-04-20
2020-04-20 164
164








