Для определения суммарного содержания фторидов в анализируемой воде использую электродную систему, состоящую из измерительного электрода, чувствительного к ионам фторида, и вспомогательного хлоридсеребряного электрода.
Измерение потенциала фторидного электрода проводят высокоомным рН- метром-милливольтметром, заменив стеклянный электрод на фторидный, или же специальным мономером.
Мешающее влияние алюминия и железа до массовой концентрации, равной их предельной допустимой концентрации в питьевой воде, устраняется введением в анализируемую пробу буферного раствора, содержащего нитрат натрия и трилон Б, которые разрушают комплексы фтора и переводят весь присутствующий фтор в состояние фторида.
Приборы и реактивы:
. Иономер типа ЭВ-74.
2. Магнитная мешалка.
. Электрод фторидный типа ЭF-YI.
. Мерные колбы на 500 мл, 100 мл.
. Пипетки мерные с делениями вместимостью 1, 2, 5, 10 и 20 мл.
. Стаканы стеклянные вместимостью 50 мл.
. Колбы стеклянные с притёртыми пробками.
. Банки полиэтиленовые вместимостью 250, 500, 1000 мл.
. Натрий фтористый «х. ч.» или «ч. д. а.».
. Натрий уксуснокислый «х. ч.» или «ч. д. а.».
. Натрий хлористый «х. ч.» или «ч. д. а.».
. Натрий лимоннокислый трехзамещённый «ч. д. а.».
. Кислота уксусная «х. ч.» или «ч. д. а.».
. Вода дистиллированная.
. Соль динатривая этилендиамин-N, N, N’, N’-тетрауксусной кислоты двухводная (трилон Б) «х. ч.» или «ч. д. а.».
Выполнение анализа.
Приготовление рабочих стандартных 0,01; 0,001; 0,0001; 0,00001 М растворов фтористого натрия.
Для приготовления 0,01 М раствора фтористого натрия 10 см основного стандартного раствора разбавляют дистиллированной водой до 100 мл в мерной колбе. Этот раствор имеет величину pF = 2 (массовую концентрацию 190 мг/дм3).
Для приготовления 0,001 М раствора фтористого натрия разбавляют 10 мл 0,01 М раствора до 100 мл дистиллированной водой в мерной колбе. Данный раствор имеет pF = 3 (массовую концентрацию 19 мг/дм3).
Для приготовления 0,0001 М раствора фтористого натрия, 10 мл 0,001 М раствора разбавляют дистиллированной водой до 100 мл в мерной колбе. Этот раствор имеет величину pF = 4 (массовую концентрацию 1,9 мг/дм3).
Для приготовления 0,00001 молярного раствор фтористого натрия готовят разбавлением 10 мл 0,0001 М раствора до 100 мл дистиллированной водой в мерной колбе. Этот раствор имеет величину pF = 5 (массовую концентрацию 0,19 мг/дм3). Все рабочие растворы готовят в день проведения анализа.
Проведение испытаний.
Подготовка к работе используемого рН-метра-милливольтметра или мономера.
В стакан вместимостью 50 мл пипеткой на 20 мл помещаем аликвоту анализируемой воды, температура воды не должна отличаться от температуры стандартных растворов по которым калибруют электрод, более чем на 2°С (в противном случае воду следует подогреть или охладить до требуемой температуры). Затем помещаем в раствор магнит от магнитной мешалки, приливаем 10 мл ацетатного буферного раствора и погружаем в раствор тщательно промытые дистиллированной водой и анализируемой водой фторидный и вспомогательный электроды, следим за тем, чтобы к поверхности мембраны фторидного электрода не прилипали пузырьки воздуха. Перемешиваем раствор магнитной мешалкой и считываем установившееся значение потенциала в милливольтах.
Результаты измерений записываем в таблицу:
| C, моль/л | 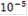
| 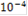
| 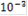
| 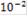
| 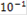
|
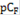
| 5 | 4 | 3 | 2 | 1 |
| Е, мВ | 502 | 387 | 291 | 196 | 101 |
Строим градуировочный график, Е, мВ - 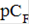
Используя градуировочный график, Е = f (рС) по величине Е находим значение С(F), моль/л. Содержание фтора в исследуемом растворе (мг/л) рассчитываем по формуле:
= 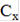 *M * 1000,
*M * 1000,
где 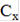 - концентрация фтора, определенная по градуировочному графику, моль/л;
- концентрация фтора, определенная по градуировочному графику, моль/л;
М - молярная масса фтора (19 г/моль).
Е, мВ = 500 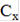 = 1,17*0,00001= 1,17*0,00001*19* 1000 = 0,22 мг/л
= 1,17*0,00001= 1,17*0,00001*19* 1000 = 0,22 мг/л
Вывод: концентрация фтора в анализируемой пробе воды 0,22 мг/л не превышает 1,5 мг/л, что соответствует требованиям ГОСТ 4386-89
 2020-04-20
2020-04-20 180
180








