Для измерения активности ионов Cl в водных растворах используют в качестве индикаторного электрода мембранный ионоселективный электрод марки Элис-131-Cl в паре с любым вспомогательным электродом. В качестве вспомогательного электрода обычно применяют хлоридсеребряный. Регистрирующий разность потенциалов прибор - любой высокоомный рН-метр - милливольтметр, ионономер типа АНИОН-4100 или специальный иономер.
Анализируемый раствор не должен образовывать пленок и осадков на мембране электрода. Определению хлоридов мешают значительные количества иодидов и бромидов.
Расчет концентрации хлоридов можно выполнять методом градуировочного графика или, проведя настройку (калибровку) иономера, сразу снимать показания значений концентраций хлоридов по шкале прибора.
Построение градуировочного графика.
мл каждого стандартного (градуировочного) раствора, начиная с раствора наименьшей концентрации (10-4М), переносим в стакан емкостью 100 мл, погружаем электроды.
Перед погружением электродов в первый градуировочный раствор их промывают три раза дистиллированной водой при интенсивном перемешивании в течение 5 минут. Затем электрод дважды промываем градуировочным раствором, с которого предусмотрено начать калибровку. При переходе к раствору большей концентрации электроды промываем этим раствором.
Так как из вспомогательного электрода в анализируемый раствор попадает определенное количество насыщенного раствора хлорид калия, изменяется ионная сила раствора. Это может увеличить погрешность в измерении концентрации растворов. Поэтому необходимо избежать длительного времени установления потенциала электрода в анализируемом растворе.
Максимальное время установления потенциала электрода не должно превышать двух минут.
По этой же причине объем анализируемой пробы не должен быть меньше 40 мл.
Результаты измерений записываем в таблицу:
| С моль/л | 10-4 | 10-3 | 10-2 | 10-1 |
| рС | 4,00 | 3,00 | 2,00 | 1,00 |
| Е, мВ х 100 | 2,8 | 1,63 | 0,4 | -0,8 |
Строим градуировочный график, Е, мВ х 100 - рС (Cl).
Отбираем мерной пипеткой 50 мл анализируемого раствора, переносим в стакан на 100 мл, погружаем электроды, предварительно промытые дистиллированной водой, включаем магнитную мешалку на 2-3 минуты. Раствор выливаем. Промывание электродов исследуемым раствором повторяем 2 раза. И лишь в третьей порции исследуемого раствора измеряем ЭДС (Е).
Обработка результатов.
Используя градуировочный график, Е = f (рС) по величине Е находим значение рС(Cl), а по нему - концентрацию хлоридов в растворе (С(Cl), моль/л). Содержание хлорида в исследуемом растворе (мг/л) рассчитываем по формуле:
= 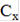 *M * 1000,
*M * 1000,
где 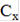 - концентрация хлора, определенная по градуировочному графику, моль/л; М - молярная масса хлора (35,5г/моль).
- концентрация хлора, определенная по градуировочному графику, моль/л; М - молярная масса хлора (35,5г/моль).
Е, мВ = 2,3 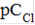 = 3,6
= 3,6 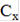 = 0,25*0,001= 0,25*0,001*35,5* 1000 = 8,875мг/л
= 0,25*0,001= 0,25*0,001*35,5* 1000 = 8,875мг/л
Вывод: из результатов проведенного нами исследования видно, что концентрация хлоридов в исследуемой пробе воды составляет 8,875 мг/л, т.е. не превышает 350 мг/л и соответствует ГОСТ 18826-73 и ГОСТ 4192-82.
Электропроводность
ИСО 7888 устанавливает метод измерения удельной электрической проводимости всех видов вод.
При помощи этого метода можно контролировать в воде наличие ионных составляющих.
В некоторых случаях анализы важны абсолютные величины удельной электрической проводимости, в других интерес представляют только относительные изменения.
Удельная электрическая проводимость ϒ - величина, обратная сопротивлению, измеряемая при заданных условиях в ячейке определенных размеров. Для определения качества воды она часто называется «электрической проводимостью» и может применяться в качестве меры концентраций ионизированных растворенных веществ, присутствующих в пробе. Выражается в сименсах на метр.
Прямое определение удельной электрической проводимости водных растворов с применением соответствующих приборов.
Удельная электрическая проводимость - мера потока, производимого ионами, присутствующими в воде («явление проводников второго рода»), и зависит от:
. Концентрация ионов;
. Природы ионов;
. Температуры раствора;
. Вязкости раствора.
Чистая вода в результате её собственной диссоциации имеет удельную электропроводность при 25°С  = 5,483 мкСм/м (0,005483 мкСм/м).
= 5,483 мкСм/м (0,005483 мкСм/м).
На измеренное значение удельной электрической проводимости может влиять загрязнение пробы внутри ячейки. Наличие большого количества взвешенных веществ, жира или масла может вызывать загрязнение электродов.
Мешающее влияние, вызванное такими воздействиями, при выполнении обычных операций нелегко обнаружить. Они могут вызвать изменение постоянной ячейки. Это можно установить лишь проверкой с помощью подходящего стандартного раствора хлорида калия.
Другие мешающие влияния обусловлены пузырьками воздуха, оседающими на электродах при нагревании пробы до 25° С.
На измерения воды с удельной электропроводностью менее 1 мкСм/м влияют атмосферная двуокись углерода и аммиак. В этих условиях измерения должны выполняться в оборудовании проточного типа.
При исследовании воды с очень низким содержанием ионов влияние удельной электрической проводимости чистой воды может быть значительным.
Вывод: Электропроводность  исследуемойравна 455 мкСм/см.
исследуемойравна 455 мкСм/см.
 2020-04-20
2020-04-20 428
428








