Водород — самый распространенный и самый легкий элемент во Вселенной.
Множество космических объектов, включая Солнце, более чем наполовину состоят из водорода.
Распространенность водорода на Земле также велика: содержание водорода в массовых долях составляет 0,88%, а в атомных — 17%.
В свободном состоянии водород почти не встречается (присутствует в выбросах газов при извержении вулканов, в продуктах разложения органических остатков)[11].
В природе находится преимущественно в виде соединений — вода океанов, морей, рек, кристаллизационная вода в минералах, метан и углеводороды нефти, природные газы, органические вещества, образующие биомассу растений, животных и почву.
Электронная конфигурация атома водорода — 1s1, его ядро — протон, единственный электрон прочно связан с ядром.
Энергия ионизации атома водорода H – e → H+ равна 1310 кДж/моль, она значительно больше первых энергий ионизации атомов щелочных металлов (529 кДж/моль для Li) и близка к первым энергиям ионизации атомов галогенов (1682 кДж/моль для F).
Теряя электрон, атом водорода превращается в катион H+ (протон), малые размеры и сильное электростатическое поле которого являются причинами активного взаимодействия его с электронными оболочками других атомов. [3]
В водном растворе ион водорода существует в виде катиона гидроксония, образующегося за счет донорно-акцепторного взаимодействия протона с молекулой воды:
H+ + H2O → H3O+.
При взаимодействии водорода с менее электроотрицательными элементами (s-металлами и неметаллами) водород образует гидрид-ион:
H + e → H‒,
выделяющаяся энергия сродства к электрону невелика и составляет 16,7 кДж/моль.
Поскольку энергия ионизации атома водорода велика, а энергия сродства к электрону небольшая, то и электроотрицательность атома водорода небольшая и составляет 2,2 по Полингу, что и определяет особенности его связей и химического поведения.
Водород существует в виде трех изотопов: легкий водород, или протий,  H (в природной смеси содержится 99,9844 мас. доли, %), тяжелый водород, или дейтерий,
H (в природной смеси содержится 99,9844 мас. доли, %), тяжелый водород, или дейтерий,  H(или Д) (0,0156 мас. доли, %) и сверхтяжелый водород, или тритий,
H(или Д) (0,0156 мас. доли, %) и сверхтяжелый водород, или тритий,  H (или Т) (≈10‒15 мас. доли, %).
H (или Т) (≈10‒15 мас. доли, %).
Тритий — радиоактивный 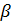 -излучатель с периодом полураспада 12,5 лет.
-излучатель с периодом полураспада 12,5 лет.
Вещества, состоящие из изотопов водорода, по химическим свойствам практически не отличаются, различны некоторые физические свойства.
Важнейшие соединения дейтерия — тяжелая вода D2O и дейтерид лития LiD.
Тяжелая вода применяется как замедлитель нейтронов в ядерных реакторах, дейтерид лития — компонент водородных бомб.
Дейтерий и тритий используют в качестве меченых атомов в научных исследованиях в химии, биологии, медицине, например для определения общего количества воды в организме.
 2020-04-20
2020-04-20 474
474








