В лаборатории водород получают по реакции:
Zn + 2HCl → Zn + H2
Или
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2.
В промышленности водород получают из природного газа, состоящего в основном из метана СН4, при высокой температуре или каталитическом пиролизе:
CH4 + H2O → CO + 3H2.
Водород высокой степени чистоты получают электролизом воды (или водного раствора KОН), на катоде выделяется водород, на аноде — кислород.[12]
Свойства водорода и его соединений.
Атомарный водород, получаемый при воздействии на молекулярный водород электрического разряда, обладает высокой химической активностью и соединяется с азотом, фосфором, серой, кислородом и другими неметаллами, восстанавливает оксиды металлов.
Молекулярный водород может проявлять как восстановительные (отдавая электроны), так и окислительные (принимая электроны) свойства.
Восстановительные свойства у водорода преобладают.
Молекулярный водород при обычных условиях взаимодействует с фтором и щелочными металлами, при нагревании или в присутствии катализатора водород реагирует со всеми галогенами (Hal):
F2, Cl2, Br2, I2:
H2 + Hal2 → 2HHal,
образуя соответствующие галогениды HHal.
Галогениды при растворении в воде образуют сильные кислоты (за исключением HF, которая является слабой кислотой, так называемая плавиковая кислота).
Сила кислот в ряду HCl — HBr — HI возрастает.
В молекуле HF проявляется водородная связь, в результате чего образуются ассоциаты (HF)n, в которых n = 2–6, простейший димер H2F2 в водном растворе диссоциирует ступенчато:
H2F2 ⇄ H+ + HF2‒ ⇄ 2H+ + 2F‒,
образуя по первой ступени диссоциации дифторогидрогенат-ион HF2‒, который может вступать в дальнейшие реакции, образуя соли:
KF + HF → K[HF2].
При более высокой температуре водород соединяется с серой, селеном, теллуром, образуя соответствующие халькогениды — H2S, H2Se, H2Te.
При высоком давлении (p ≈ 30 МПа) и повышенной температуре (T ≈ 4500C) водород соединяется с азотом, образуя аммиак NH3.[13]
Реакция водорода с кислородом в присутствии катализатора протекает практически необратимо с выделением большого количества теплоты:
2H2 + O2 → 2H2O.
Газовая смесь, состоящая из двух объемов водорода и одного объема кислорода, называемая гремучим газом, взрывается при поджигании.
В этих реакциях водород является восстановителем и в образующихся соединениях проявляет степень окисления +1.
Молекулы воды легко координируются с катионами металлов и H+ с образованием комплексных соединений:
CuSO4 + 4H2O → [Cu (H2O)4]SO4, H2O + H2O ⇄ H3O+ + OH‒.
H2O — слабый амфотерный электролит, способный как отдавать, так и присоединять катионы H+.
Чаще используют упрощенное уравнение равновесия диссоциации воды:
H2O ⇄ H+ + OH‒.
В окислительно-восстановительных реакциях вода может выступать как в роли восстановителя, так и в роли окислителя:
2H2O + 2e ⇄ H2 + 2OH‒,
2H2O ‒ 4e ⇄ O2 + 4H+.
Кроме оксида H2O водород образует пероксид H2O2, молекула которого имеет большой электрический момент μ = 7,54·10‒30 Кл·м благодаря тому, что связи O–H расположены в разных плоскостях.
Чистый пероксид H2O2 представляет собой бесцветную вязкую жидкость с температурами кипения и плавления, близкими к таковым для воды.
Пероксид водорода разлагается при нагревании, освещении или в присутствии катализатора, иногда — со взрывом:
2H2O2 → O2 + 2H2O.
В водных растворах H2O2 диссоциирует как очень слабая кислота с образованием гидропероксид-иона HO2‒:
H2O2 ⇄ H+ + HO2‒.
Кислород в молекуле H2O2 имеет промежуточную степень окисления –1, поэтому в химических реакциях может проявлять и окислительные (а), и восстановительные (б) свойства:
(а) H2O2 — окислитель:
H2O2 + 2KI + H2SO4 → I2 + 2H2O + K2SO4,
(б) H2O2 — восстановитель:
5H2O2 + 2KMnO4 + 3H2SO4 → 5O2 + 2MnSO4 + K2SO4 + 2H2O.
Окислительные свойства H2O2 проявляются в большей степени.
Водные растворы H2O2 используются для обеззараживания сточных вод, отбеливания бумаги и тканей, как дезинфицирующее средство в медицине, 30%-ный раствор H2O2 с добавками стабилизаторов известен под техническим названием пергидроль.
Реагируя со щелочным или щелочноземельным металлом, водород выступает в роли окислителя:
2Na + H2 → 2NaH,
образуя гидриды, в которых степень окисления водорода –1.
Гидриды щелочных и щелочноземельных металлов — твердые солеобразные вещества с ионной связью, сильные восстановители:
NaH + H2O → NaOH + H2.
Гидрид-ион, имея неподеленную электронную пару, легко вступает в реакции коплексообразования:
AlH3 + H‒ → [AlH4]‒,
в которых H‒ является донором, Al3+ — акцептором.
Водород и его соединения находят широкое применение в различных производствах:
− в органическом синтезе для получения спиртов, альдегидов, кетонов;
− для получения аммиака;
− в пирометаллургии;
− для очистки продуктов переработки нефти;
− для гидрогенизации твердого и жидкого топлива;
− сварке и резке металлов;
− изотопы водорода — дейтерий и тритий используются в ядерной энергетике;
− в микробиологии: тяжелая вода — как теплоноситель и замедлитель нейтронов.
Расчет материального и энергетического балансов процесса получения водорода
Материальный баланс
По закону Фарадея в результате прохождения через электролит двух фарадеев электричества на катоде выделяется 2 г-экв водорода (1 моль занимающий при нормальном давлении и температуре 0,0224) и 1 г-экв кислорода (0,5 моля - объем 0,0112) и израсходован 1 моль воды.
Фактически водорода и кислорода выделяется меньше, так как выход по току в этом процессе ниже 100 % и составит 95-98%, а воды израсходуется больше из-за уноса ее паров с газами. [2]
Паров уносится тем больше, чем выше температура, при которой идет электролиз.
Материальный баланс ¾ это количество загружаемых реагентов и получаемых продуктов на каждой стадии технологического процесса с учетом промежуточных и побочных продуктов.
Материальный баланс составляется на основании закона сохранения массы вещества - количество веществ, вступивших в реакцию, равно количеству веществ, полученных в результате реакции.
Приходные статьи баланса
Расход воды на электролиз
 =
=  ,
,
где  , - электрохимический эквивалент воды, г/А
, - электрохимический эквивалент воды, г/А  ч;
ч;
 = 0,336∙1∙192∙1000∙0,95 = 61386,4 г/ч
= 0,336∙1∙192∙1000∙0,95 = 61386,4 г/ч
или  = 61,38 кг/ч
= 61,38 кг/ч
Расходные статьи баланса
На катоде выделяется газообразного водорода за 1 час:
K:2  =
= 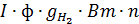 ,
,
где I ¾ cила тока, проходящего через электролизер, а n ¾количество ячеек в электролизере, шт;
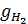 ¾ электрохимический эквивалент водорода, г/А∙ ч;
¾ электрохимический эквивалент водорода, г/А∙ ч;
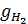 = 2/2∙ 26,8 = 0,037 г/А ∙ч
= 2/2∙ 26,8 = 0,037 г/А ∙ч
Или 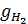 = 22,4/2∙ 26,9 = 0,418 л/А ∙ ч
= 22,4/2∙ 26,9 = 0,418 л/А ∙ ч
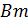 ¾ выход по току, доли; ф ¾продолжительность электролиза, час.
¾ выход по току, доли; ф ¾продолжительность электролиза, час.
 = 1000∙1∙0,037∙0,95∙192 = 6748,8 г/ч
= 1000∙1∙0,037∙0,95∙192 = 6748,8 г/ч
или  = 6,7 кг/ч
= 6,7 кг/ч
На аноде выделится газообразный кислород за 1 час:
A: 2О+1/2
 = I∙ф ∙Bm∙ n
= I∙ф ∙Bm∙ n 
где  ¾ электрохимический эквивалент кислорода, г/А∙ч;
¾ электрохимический эквивалент кислорода, г/А∙ч;
 = 16/2∙26,8 = 0,298 г/А∙ч
= 16/2∙26,8 = 0,298 г/А∙ч
или  = 11,2/2∙26,8 = 0,209 л/А∙ч
= 11,2/2∙26,8 = 0,209 л/А∙ч
 =1000∙1∙192∙0,298∙0,95 = 55355,2 г/ч
=1000∙1∙192∙0,298∙0,95 = 55355,2 г/ч
Или  = 55,3 кг/ч
= 55,3 кг/ч
Расход воды на испарение.
Для расчета требуется найти объем газов в реальных условиях, то есть в условиях температуры и влажности атмосферы промышленного предприятия.
Объем выделившихся за 1 час газов - водорода и кислорода
 =
= 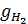 ∙ Bm∙ I∙n∙ф = 0,418∙0,98∙1000∙192∙1 = 78650,88
∙ Bm∙ I∙n∙ф = 0,418∙0,98∙1000∙192∙1 = 78650,88
 =
=  ∙ Bm∙ I ∙ n ∙ ф = 0,209 ∙ 0,98 ∙ 1000 ∙ 192 ∙ 1 = 39325,44
∙ Bm∙ I ∙ n ∙ ф = 0,209 ∙ 0,98 ∙ 1000 ∙ 192 ∙ 1 = 39325,44
Объем влажного газа при реальной температуре:
где p - давление насыщенного водяного пара при температуре воздуха, Па;
B- барометрическое давление, Па;
t - реальная температура в аппарате.
 = 78650,88 ∙760∙ (273+80) / 273 ∙ (7502 - 17,5) ∙0,995 = 10378,8 л
= 78650,88 ∙760∙ (273+80) / 273 ∙ (7502 - 17,5) ∙0,995 = 10378,8 л
 = 39325,44 ∙760 ∙ (273+80) / 273 ∙ (7502 - 17,5) ∙0,995 = 5189,3
= 39325,44 ∙760 ∙ (273+80) / 273 ∙ (7502 - 17,5) ∙0,995 = 5189,3
Суммарный объем влажных газов:
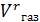 =
=  +
+  = 10378,8 + 5198,3 = 15568,1 л
= 10378,8 + 5198,3 = 15568,1 л
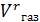 = 15,6 м3
= 15,6 м3
 = 15,6 * 20 *10-3 = 0,31 м/час
= 15,6 * 20 *10-3 = 0,31 м/час
| Приход | Расход | ||
| Вещество | Масса (кг/ч%) | Вещество | Масса (кг/ч%) |
| Обессоленная вода | 61,4 | Водород (газ) | 5,99 |
| Кислород (газ) | 55,3 | ||
| Вода | 0 | ||
| На унос газами: | 0,31 | ||
| Итого | 61,4 | 61,6 | |
Потери находятся в допустимых пределах.
 2020-04-20
2020-04-20 253
253








