К 10,00 мл раствора гидрата аммиака с концентрацией 0,1051 моль/л добавили раствор серной кислоты с концентрацией 0,0546 моль/л и объемом 14,45 мл.
Константа основности гидрата аммиака Kb(NH3·H2O)=1,74·10-5.
- Напишите уравнение титриметрической реакции в молекулярном и сокращенном ионном виде.
- Укажите формулы эквивалентных частиц анализируемого вещества и титранта.
- Рассчитайте степень оттитрованности τ анализируемого компонента.
- Укажите состав раствора при установлении в титриметрической системе равновесия.
- Выведите формулу и рассчитайте [H3O+] и pH раствора при полученном τ.
- Изобразите схематично графики зависимости:
pH=f(τ), рОН =f(τ),. [H3O+]=f(τ), [OH-]=f(τ),
Решение
С пункта 1 по пункт 3 включительно – из задачи 2-4.
4. Необходимо записать общую формулу для расчета степени оттитрованности:
по определению «степень оттитрованности» показывает отношение количества вещества (моль-эквивалентного) добавленного титранта в определенный момент времени к количеству титранта, который надо добавить к анализируемому компоненту, чтобы реализовать момент эквивалентности:
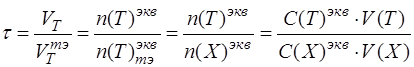
Подставить в формулу конкретные формулы эквивалентных частиц титранта и анализируемого вещества:
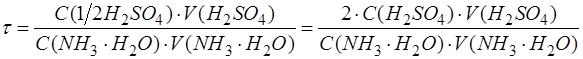
Затем подставить в формулу числа, соответствующие параметрам. Рассчитать, записать результат с запасом цифр и округлить степень оттитрованности до сотых, используя правила округления числа:
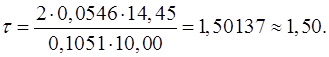
5. Необходимо указать состав раствора при рассчитанном значении степени оттитрованности:
τ=1,50 > 1, следовательно, это область перетитрованного раствора гидрата аммиака.
Состав раствора в области перетитрованного анализируемого компонента Х состоит из продуктов соответствующей протекающей реакции или протекающих реакций на этот момент и избыточного количества компонента титранта Т.
Таким образом, в нашем случае состав раствора при τ=1,50 > 1 состоит из:
NH4+, SO42-, Н3O+, H2О.
Следует отметить, что равновесие в титриметрической системе устанавливается не только в точке эквивалентности, то есть устанавливается всегда независимо от того, добавили или сколько добавили титранта к анализируемому компоненту.
6. Для расчета равновесной концентрации протонов водорода в титриметрической системе при рассчитанном значении степени оттитрованности необходимо сначала найти в составе раствора рН -определяющую частицу.
рН -определяющей частицей является частица, которая при взаимодействии с водой может подавлять равновесие автопротолиза растворителя и давать кислую или щелочную среду. Это кислоты, основания, гидролизующиеся анионы или катионы, амфолитные ионы. Если таких частиц нет, то рН- определяющей частицей будет растворитель - H2О, рН которого рассчитывается из соответствующей константы автопротолиза и равен 7.
В нашем случае:
NH4+ – гидролизующийся катион (продукт титриметрической реакции),
SO42- – негидролизующийся анион,
H2О – растворитель,
Н3O+ – сильная кислота (титрант).
В составе раствора присутствуют две частицы, способные каждая в отдельности влиять на рН раствора: катион от слабого основания, который проявляет слабо кислые свойства, и сильная кислота – титрант, который в перетитрованной области находится в избытке. Поскольку гидролиз катиона слабого основания – это равновесие, и оно практически сдвинуто в левую сторону, то присутствие сильной кислоты по принципу Ле Шателье полностью подавляет этот процесс. Таким образом, рН -определяющей частицей в растворе со смесью сильного и слабого электролитов с одноименным свойством является сильный электролит, то есть в нашем конкретном случае это титрант – сильная кислота.
Поэтому при выводе формулы для расчета рН в области перетитрованного слабого основания необходимо найти избыточную концентрацию титранта.
Избыточное содержание H2SO4 (T) находят по разнице между добавленным количеством титранта в перетитрованной области и его количеством, которое пошло на взаимодействие с анализируемым компонентом, согласно стехиометрии реакции:
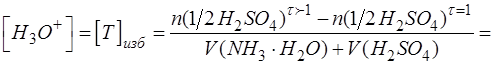
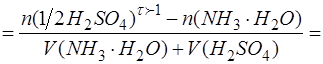
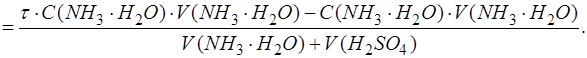
При выражении используем закон эквивалентов и формулу для расчета степени оттитрованности:
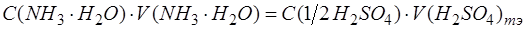
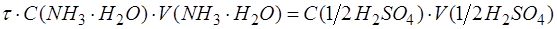
После преобразований получим:
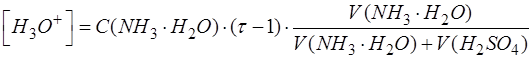
где:
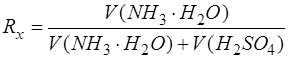 - разбавление анализируемого компонента.
- разбавление анализируемого компонента.
Подставляем соответствующие числовые значения в формулу, рассчитываем, записываем результат с запасом цифр и округляем значение.
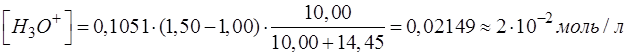
При выводе формул для расчета pH от степени оттитрованности необходимо использовать известное выражение:
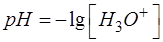
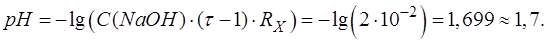
Равновесную концентрацию протонов водорода [H3O+] округляем до целых, значение рН – до десятых.
Пункт 7 аналогичен пункту 7 задачи 2-4.
Таблица с заданиями для самостоятельного решения
 2020-05-11
2020-05-11 132
132








