Тема 2. Химическая связь и строение вещества
Внешние оболочки большинства атомов (кроме благородных газов) являются незавершенными. В процессе химического взаимодействия, при образовании химической связи, они завершаются.
Различают три основных вида связи – ковалентную, ионную, металлическую.
Ковалентная химическая связь, её разновидности и механизмы образования
Ковалентная связь – это связь, возникающая между атомами за счет образования общих электронных пар. Она образуется в результате перекрывания электронных облаков атомов, сопровождающегося выделением энергии.
Термин «ковалентная» следует понимать, как объединенная, приставка ко- означает совместное участие.
Рассмотрим образование молекулы Cl2 из двух атомов хлора.
На внешнем энергетическом уровне у атома хлора 7 электронов: 3s23p5. Обозначим электроны внешнего слоя точками – рисунок 5.
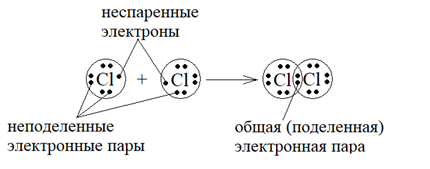
Рисунок 5 – Образование химической связи в молекуле Cl2
Здесь образование ковалентной связи происходит за счет неспаренных p -электронов каждого атома. При сближении атомов неспаренные электроны связываются в общую пару электронов, называемую поделенной или обобществленной.
Ковалентная s- и p-связь
Если связь осуществляется одной общей электронной парой – возникает одинарная связь, перекрывание орбиталей происходит вдоль линии, соединяющей центры атомов. Такая связь еще называется s-связью. Одинарная связь в молекулах водорода (s – s связь), галогенов (p – p связь), галогенводородов (s – p связь) (рисунок 6). Если электроны, образующие ковалентные связи, находятся в различных состояниях (например, в s и p), тогда при образовании связи они выравниваются по форме и энергии – гибридизуются, что приводит к образованию равных по длине и энергии связей. sp 3, sp 2, sp гибридизация будут разобраны в блоке «Органическая химия».
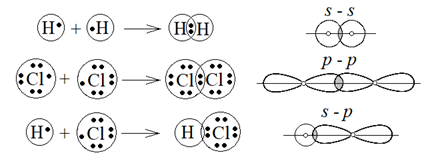
Рисунок 6 – Образование s-связи
Часто между атомами возникает кратная связь – двойная, тройная. Она осуществляется двумя или тремя общими электронными парами соответственно. В этом случае кроме перекрывания орбиталей вдоль линии, соединяющей центры атомов (s-связи), возникает дополнительное перекрывание орбиталей, направленных перпендикулярно линии связи. Эти дополнительные связи называются p-связи.
Так, если в атоме два неспаренных p -электрона, при образовании молекулы возникает два перекрывания орбиталей – одно вдоль линии, соединяющей центры атомов, второе – перпендикулярно им, образуется двойная связь – одна из них s-, вторая p- (рисунок 7).

Рисунок 7 – Образование p-связи
В молекуле азота тройная связь (одна s- и две p-), так как в атомах азота 3 неспаренных p -электрона (рисунок 8).

Рисунок 8 – Тройная связь в молекуле азота
Не во всех молекулах химическую связь можно объяснить подобным простым перекрыванием облаков. Например, образование молекулы кислорода нельзя трактовать возникновением двух поделенных электронных пар (рисунок 9 а), так как известно, что О2 парамагнитен, втягивается в магнитное поле, а значит имеет неспаренные электроны. Более правильный вариант представлен на рисунке 9 б.

а б
Рисунок 9 – Образование молекулы кислорода
 2020-05-12
2020-05-12 1588
1588