Если ковалентная связь возникает между атомами одного элемента, то общая электронная пара в равной степени принадлежит обоим атомам. Электронные облака каждого атома распределяются симметрично относительно этих атомов. В этом случае связь неполярна. Неполярная связь в молекулах H2, Cl2, O2, N2, F2, S8 и др.
Если ковалентная связь возникает между атомами разных элементов, то электронное облако связи смещается к атому с большей электроотрицательностью: в молекуле HCl от водорода к хлору, в молекуле H2O от водорода к кислороду, в молекуле SO3 от серы к кислороду, в ионе IO3– от йода к кислороду и т.д. Такая связь полярна, даже если элементы незначительно отличаются по электроотрицательности.
Донорно-акцепторный механизм образования ковалентной связи
В рассмотренных выше примерах, ковалентная связь образована по обменному механизму – за счет перекрывания одноэлектронных облаков каждого атома.
Возможен другой механизм – за счет двухэлектронной орбитали одного атома (донора) и свободной орбитали другого атома – акцептора. Такая ковалентная связь называется донорно-акцепторной или координационной.
Рассмотрим ее на примере образования иона аммония NH4+. В молекуле аммиака NH3 три связи ковалентные, образованные по обменному механизму (рисунок 10 а).
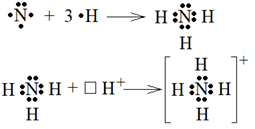
Рисунок 10 – Образование молекулы аммиака (а) и иона аммония (б)
При этом у азота остается двухэлектронное облако (неподелённая пара электронов). У иона H+ нет электронов, но есть свободная 1 s -орбиталь. При взаимодействии
NH3 + H+ ® NH4+
двухэлектронное облако азота становится общим для азота и Н+, т.е. возникает четвертая связь, по свойствам не отличающаяся от остальных трех. Заряд «+» становится общим для всего иона (рисунок 10 б).
Донорно-акцепторный механизм образования ковалентной связи достаточно распространен, следует запомнить, что он реализуется при образовании ионов NH4+, H3О+, NО3– в молекулах СО, HNО3, в комплексных соединениях.
Характеристики ковалентной связи
1 Длина связи
Длина связи – расстояние между ядрами атомов, образующих связь. Химическая связь тем прочнее, чем короче связь.
В однотипных соединениях длина связи изменяется закономерно с атомными радиусами элементов. Например, в молекулах HF–HCl–HBr–HI длина связи возрастает, т.к. увеличивается радиус атомов в ряду F–Cl–Br–I.
2 Энергия связи
Энергия связи – энергия, выделяющаяся при образовании химической связи или затрачиваемая на её разрыв.
В однотипных молекулах наблюдается зависимость между длиной и энергией связи: чем меньше длина связи, тем больше ее энергия, т.е. связь прочнее. Например, в ряду HF–HCl–HBr–HI уменьшается энергия связи.
Чем больше кратность связи, тем она короче и прочнее (больше энергия связи).
3 Насыщаемость связи
Под насыщаемостью понимают способность атомов образовывать ограниченное число ковалентных связей. В первом приближении – количество связей равно количеству неспаренных электронов в атоме (например, у водорода один неспаренный электрон, у кислорода два, у углерода в возбужденном состоянии четыре). Насыщаемость связи аналогично понятию валентность элемента. Следует понимать, что при насыщенных ковалентных связей по обменному механизму, могут образовываться ковалентные связи по донорно-акцепторному.
Направленность связи
Максимальное перекрывание валентных электронных облаков взаимодействующих атомов, а значит и прочность связи, возможно при определенной их взаимной ориентации.
Направленность связи обуславливает пространственную структуру (форму) молекул. Так, молекула HCl линейна, H2О – имеет угловую форму, NH3 и CH4 – форму пирамиды. Форма молекул определяется количеством связей, наличием неподеленных электронных пар, гибридизацией.
Задания на определение формы молекул в ЕГЭ отсутствуют, поэтому в данном пособии этот раздел не рассматривается.
Ионная связь
Ионная связь – связь между ионами, осуществляемая электростатическим притяжением.
Ионная связь имеет место, если атомы, образующие связь, резко отличаются по электроотрицательности.
В заданиях ЕГЭ связь считается ионной, если разница в относительной электроотрицательности (ОЭО) у атомов > 1,7. Надо запомнить, что ионная связь возникает
– между ионами в солях;
– в оксидах и гидридах щелочных и щелочноземельных металлов.
Рассмотрим образование ионной связи на примере хлорида натрия NaCl. Натрий щелочной металл, на его внешнем энергетическом уровне 1 электрон (3 s 1), ОЭО (Na) = 0,9. Хлор – галоген, на его внешнем энергетическом уровне 7 электронов (3 s 13 p 5), ОЭО (Cl) = 3,1. Для перехода в устойчивое состояние благородного газа натрий легко отдает электрон, а хлор его принимает. Поэтому при сближении атомов возникающая связь настолько полярна, что можно говорить о возникновении положительной частицы иона натрия Na+ и отрицательной частицы иона хлора Cl– (рисунок 11).
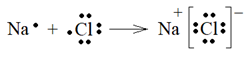
Рисунок 11 – Возникновение ионов натрия и хлора
Разноименно заряженные ионы притягиваются, образуя вещество с ионной кристаллической решеткой. В твердом состоянии такие вещества состоят не из молекул, а из чередующихся положительных и отрицательных ионов (рисунок 12).
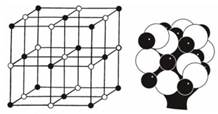
Белые кружки – ионы хлора, черные – ионы натрия
Рисунок 12 – Кристаллическая решетка и модель структуры хлорида натрия[1]
Ионная связь осуществляется силами электростатического взаимодействия, поэтому не обладает ни направленностью, ни насыщаемостью.
Металлическая связь
Атомы металлов на внешнем энергетическом уровне содержат небольшое число электронов и, соответственно, избыток вакантных орбиталей. При сближении атомов их орбитали перекрываются, и внешние электроны могут свободно перемещаться из одной орбитали в другую, осуществляя химическую связь между всеми атомами кристалла металла. Этот тип связи называется металлической. Все металлы в твердом и жидком состоянии образованы этим типом связи.
Электроны, осуществляющие связь в металле обобществлены и легко могут перемещаться по всему кристаллу металла. Это придает всем металлам общие физические свойства: высокую тепло- и электропроводность, металлический блеск, пластичность, ковкость.
Водородная связь
Выше были рассмотрены три основных вида химической связи, которыми осуществляется связь между атомами в простых веществах и соединениях. Между молекулами, функциональными группами, ионами в растворе существуют другие, более слабые, т.н. дополнительные виды связи. Наибольшее значение имеет водородная связь.
Водородной связью называется дополнительная связь, осуществляемая между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом другой молекулы, характеризующимся большей электроотрицательностью (прежде всего, кислорода, фтора, азота). Водородная связь обычно обозначается точками (рисунок 13).
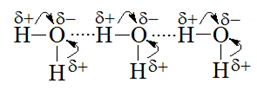
Рисунок 13 – Возникновение водородной связи
Водородная связь играет важную роль в процессах растворения, диссоциации, кристаллизации. Благодаря ей ассоциированы при комнатной температуре легкие молекулы H2O, HF. Особенно распространена водородная связь в молекулах белков, нуклеиновых кислот. Легко образовываясь и разрываясь, она регулирует биологические процессы.
В заданиях ЕГЭ предлагается выбрать соединения, между молекулами которых образуется водородная связь. Это часто вызывает затруднения: водородную связь путают с ковалентной связью с атомом водорода; не учитывают, что для образования сильно поляризованных (заряженных) атомов связь между ними должна быть достаточно полярной. Иначе говоря, водородная связь образуется между молекулами веществ, в которых атом водорода непосредственно связан с атомом с высокой электроотрицательностью (фтором, кислородом, азотом).
Пример 2. Определите два вещества, между молекулами которых образуется водородная связь: формальдегид, водород, метанол, толуол, муравьиная кислота.
Решение. Молекулы водорода и толуола не содержат атомов кислорода, фтора, азота. В молекуле формальдегида атом кислорода непосредственно с водородом не связан (рисунок 14), поэтому водород в молекуле недостаточно поляризован и водородные связи не образуются. В молекулах метанола и муравьиной кислоты атом водорода непосредственно связан с атомом кислорода, связь О–Н сильно поляризована, образуются водородные связи.
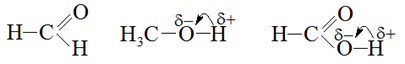
Рисунок 14 – Решение примера 2
 2020-05-12
2020-05-12 272
272








