Для предельных углеводородов характерна реакция замещения с галогенами: Fe2; Cl2; Br2; J2.
Все предельные углеводороды горят с образованием углекислого газа и воды и разлагаются без доступа воздуха на составляющие элементы.
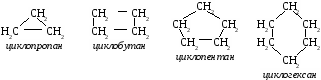
Циклоалканы.
Σ = 180° (п – 2) формула для расчета величины угла в правильном
Получение предельных углеводородов.
1. Реакция Вюрца.
CH3Cl + 2Na + CH3Cl → CH3 – CH3 + 2NaCl
2. Переработка нефти и попутных нефтяных газов.
ТЕСТ ПО ТЕМЕ «АЛКАНЫ»
Вариант №1
1. Диметилпропан относится к классу углеводородов, общая формула которого
а) CnH2n+2 в) CnH2n -2
б) CnH2n г) CnH2n+1
2. Гомологом этана является
а) С2Н4 в) СН3- CH2 - CH2 - СН3
б) С3Н4 г) С6Н12
3. Какой вид изомерии характерен для алканов:
а) положения двойной связи в) углеродного скелета
б) пространственная г) гомологических рядов
4. Угол связи в молекулах алканов составляет
а)109028 б)1200 в) 1800 г) 10405
5. В уравнении полного сгорания пентана коэффициент перед формулой кислорода равен
а) 5 б) 8 в) 6 г) 9
6. Пропан взаимодействует с: а) Br2 в) HCl
б) H2 г) NaOH (р-р).
7. Газообразные алканы – это:
а) СН4, С4Н10, С10Н22 в) С6Н14, С5Н12, С5Н10
б) С3Н8, С2Н6, С4Н10 г) С7Н16, С6Н14, С10Н22.
8. Реакция 2СН3I + 2Na = 2NaI + C2Н6 носит имя:
а) Зинина; в).Вюрца;
б) Бутлерова; г) Менделеева.
9. Установите соответствие между формулой вещества и его названием:
Структурная формула Название вещества
СН3
| 1) 2 – метилпентан
а) СН3 –C – СН3 2) пентан
| 3) бутан
СН3 4) 2,2 - диметилпропан
б) СН3 – СН2 – СН2 – СН3 5) гептан
в) СН3 – (СH2)5 – СН3 6) гексан
г) СН3 – СН – СН2 – СН2 – СН3
|
СН3
10. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
Реагирующие вещества:
Продукты взаимодействия:
а) CН4 + Cl2 →
1) CО2 + Н2
б) C2Н6 + О2 →
2) C2Н6 + NаCl
в) CН3Cl + Nа →
3) CН3Cl + НCl
г) С3Н8 →
4) CО2 + Н2О
5) CН2Cl2 + Н2
6) C + Н2
ТЕМА 2.3. РЕШЕНИЕ ЗАДАЧ, СВЯЗАННЫХ С ПОНЯТИЕМ
"ВЫХОД ПРОДУКТА РЕАКЦИИ".
η (выход продукта) - масса, или объем продукта реакции.
выход теоретический - всегда 100 %
выход практический –
Задача 1. При обжиге 500 кг СаСО3 получили 240 кг СаО. Определить выход оксида кальция в %от теоретически возможного.
Дано:
Решение:
Ответ: ηСаО = 85,7%
ηСаО =?
Задача 3. Сколько граммов CaC2 ввели в реакцию, если при этом получили 5,6 л С2Н2, что составляет 80%от теоретически возможного выхода?
Лекция.ТЕМА 2.4: ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ
Углеводороды, содержащие в углеродной цепи одну или несколько кратных (двойных или тройных) углерод-углеродных связей, называют непредельными. Термин «непредельные» означает, что атомы углерода не до предела насыщены атомами водорода и, как следствие, склонны к реакциям присоединения.
 2020-05-12
2020-05-12 324
324








