
Анализ данных табл. 16, характеризующих активность мышечной холинэстеразы у контрольных карасей, показывает, что хотя в норме активность фермента и подвержена индивидуальным колебаниям, однако средняя его активность весьма сходна у особей каждой из пяти контрольных групп и различия между крайними ее значениями не превышают 25%. В то же время активность мышечной холинэстеразы у подопытных карасей на 200-240% ниже, чем у контрольных. Изменение активности холинэстеразы во времени (рис. 16) показывает, что максимальное ее падение приходится на 60-ю минуту токсического воздействия фенола на рыб. Именно к этому сроку караси полностью теряют подвижность, и только впоследствии у них появляются редкие импульсивные перемещения (чаще по кругу) в боковом положении. Ход кривой на рис. 16 показывает также, что к 120-й минуте у подопытных карасей имеет место некоторое повышение активности холинэстеразы (на 32%) в сравнении с ее активностью, зарегистрированной на 60-й минуте, но она все еще значительно ниже, чем у контрольных карасей.
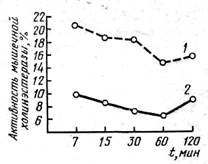
Рис. 16. Динамика изменений активности мышечной холинэстеразы
у контрольных 1 и подопытных 2 карасей.
Полученные в этой серии опытов данные, свидетельствующие о резком торможении активности холинэстеразы — важнейшего звена ацетилхолинового метаболизма, позволяют понять биохимическую основу 2-фазового действия фонола на рыб. По-видимому, первоначальное возбуждающее действие фенола на рыб, проявляющееся в сильнейшей, но кратковременной двигательной реакции, обусловлено торможением холинэстеразы фенолом (прямым или каким-либо косвенным путем), которое приводит к стабилизации «физиологического» ацетилхолина. Последующее накопление ацетилхолина до максимальных концентраций лежит в основе парализующего действия фенола, имеющего место во второй стадии фенольной интоксикации. Таким образом, два наиболее типичных эффекта фенольной интоксикации — возбуждающее и парализующее действие — можно толковать как результат инактивации холинэстеразы, и, следовательно, накопления ацетилхолина в холинэргических синапсах. В качестве подтверждения такой точки зрения в следующей главе будут приведены результаты опытов по торможению внешнего симптомокомплекса фенольной интоксикации. посредством антихолинэстеразных препаратов.
За рубежом первая работа с холинэстеразой была выполнена К. Всйссом [841, 842], но тоже оказалась несколько «преждевременной», ибо только начиная со второй половины 60-х годов там стали регулярно появляться публикации, в которых показателем токсичности служила активность холинэстеразы мозга, крови и других тканей, В исходных опытах К. Всйсса исследовалось влияние фосфорорганических пестицидов (карбофос, ДДВФ, дельнав и паратион) на холинэстеразу мозга четырех видов рыб: серебряного карася (Carassius auratus), ушастого окуня (Lepomis macrochirus), черноголовой пимефалес (Pimephales promelas) и нотемигонуса (Notemigonus crysoleucas). В острых опытах, длившихся 12-24 ч, выявлены видовые различия в токсикорезистентности исследованных рыб, показателем которой служила степень инактивации фермента. Наиболее чувствительным к воздействию токсиканта оказался ушастый окунь, у которого в течение 12 ч концентрация карбофоса 0,1 мг/л вызывала снижение активности фермента на 82%, т. е. в 4 раза более интенсивнее, чем, скажем, у черноголовой пимефалес. В настоящее время накоплен большой экспериментальный материал, однозначно свидетельствующий о влиянии различных токсикантов на холинэстеразу рыб и возможности ее использования в качестве индикатора токсичности.
Холинэстеразы
В конце 40-х — середине 50-х годов в опытах на теплокровных животных было установлено, что ядохимикаты фосфорорганичеокой группы оказывают токсичеокое действие на организм путем инактивации холинэстеразы, осуществляющей ферментативный гидролиз важнейшего медиатора — ацетилхолина. Фосфорорганические вещества в силу своего структурного сходства с ацетилхолином, вступая в соединение с холинэстеразой (реакция ацилирования), лишают ее способности расщеплять ацетилхолин. В результате этого происходит накопление ацетилхолина и перевозбуждение холинэргических структур. Фосфорорганические ингибиторы взаимодействуют с эстеразным центром фермента [254]. В соответствии с современной номенклатурой ферментов различают два типа холинэстераз: ацетилхалинэстеразу (ацетилхолин-гидролаза, шифр 3.1.1.7) и холинэстеразу (ацилхолин-ацигидролаза, шифр 3.1.1.8). Первый из этих ферментов локализован в мозговой ткани, симпатических ганглиях, эритроцитах, а второй — в сыворотке крови, печени и в некоторых других органах и тканях. Как мы уже отмечали, первые опыты по влиянию фосфорорганических пестицидов на ацетилхолинэстеразу мозга рыб выполнены К. Вейссом [841, 842], однако целенаправленное изучение этого вопроса началось несколько позже. В серии работ были представлены материалы [854, 605, 493, 494, 679, 423, 561, 601, 446, 748, 496, 497, 495, 3, 206], свидетельствующие об угнетении ацетилхолинэстеразы мозга (АХЭ) многими фосфорор-ганическнми пестицидами у разных видов рыб. Приведем некоторые факты.
Резкое снижение активности АХЭ мозга ципринодонта отмечено в опытах с тремя пестицидами: паратионом, форатом и гутионом, причем угнетение активности фермента па 83% вызывает гибель рыб, я на 13% — выраженный токсический эффект [493, 494]. Сходные данные получены и в опытах на гамбузиях: при концентрации па-ратиона 0,4 мг/л активность АХЭ мозга снижается на 60,5% [679]. Аналогичный по выраженности токсический эффект отмечен и в опытах с тремя другими видами рыб (Lepomis cyanellus, Lepomis macrochirus, Notemigonus chrysoleucas): при концентрации токсиканта 0,2 мг/л отмечается угнетение активности АХЭ мозга соответственно на 84, 80 и 59% [561]. Еще один фосфорорганический пестицид —параоксан — концентрацией 3-10-8 ингнбирует АХЭ мозга трески уже при 3 — G-часовом воздействии на рыб. Угнетение активности АХЭ мозга солнечника на 50% вызывает интоксикация рыб метилпаратионом концентрацией 200 мг/л, а увеличение концентрации в три раза — АХЭ мышечной ткани [446].
Четко выраженные видовые различия по степени угнетения активности АХЭ мозга карбофосом выявлены в опытах на лососевых [748]. Карбофос в концентрации 0,4—3,0 мг/л (при 7—10-суточной экспозиции) вызывал снижение активности АХЭ мозга кижуча (Omorhynchus Ijjsutch) на 75%, мозга радужной форели (Salmo gairdnerii) на 45 % и мозга ручьевой форели (Salvclinus fontiualjs на 25% по сравнению с его активностью у контрольных особей. Этими данными подтверждаются исходные наблюдения К. Вейсса [842] о существовании у рыб видовых особенностей устойчивости АХЭ мозга.
Обстоятельное изучение характера и выраженности влияния трех осфорорганических пестицидов (фосфамид, цидиал, диенстон) на ХЭ мозга сеголетков и годовиков карпа (Cyprinus carpio) выполнено в лаборатории М. М. Телитченко Мохамедом Али [3].
Воздействие на рыб фосфамида в концентрации 0,01 мг/л вызывает снижение активности АХЭ мозга на 45 % по сравнению с его активностью у контрольных особен на 21-е сутки с момента начала опытов. В растворе фосфамида концентрацией 5 мг/л карпы погибают на 9-е сутки, а снижение активности АХЭ мозга на 40 % отмечается у них уже через 8 ч. Воздействие цидиала с концентрацией 0,01 мг/л на 21-е сутки опыта угнетает активность АХЭ у подопытных рыб на 57% по сравнению с активностью АХЭ у контрольных особей, но в острых опытах (1 мг/л) резкое падение активности АХЭ мозга (на 45%) отмечается уже через 8 ч, а гибель рыб — через 9 сут. Судя по пороговой концентрации, вызывающей выраженный антихолинэстеразный эффект, наиболее токсичным для карпа оказался дисистон. Уже при концентрации 0,001 мг/л этого фосфорорганического пестицида активность АХЭ мозга угнеталась на 42%. При более высокой концентрации фосфамида (0,5 мг/л) через 8 ч происходит снижение активности АХЭ мозга па 44% от активности у контрольных рыб, через 24 ч — на 85%, а на 3-й сутки, к моменту гибели рыб — на 92% от активности у контрольных рыб.
Автор приходит к выводу, что угнетение активности АХЭ мозга карпа в первые часы после помещения рыб в растворы пестицидов до 50% и ниже является прогностическим показателем летального исхода в течение 10 сут.
Анализируя накопленные к настоящему времени экспериментальные данные по характеру и выраженности влияния фосфорорганических пестицидов на активность АХЭ мозга рыб, необходимо подчеркнуть однотипность реакции рыб и теплокровных животных на токсическое воздействие этой группы ядохимикатов. Все 12 использованных в опытах пестицидов (паратион, малатион, гутион, карбофос, дихлорофос, дисистон, цидиал, фосфамид, форат, параоксан, дельнав, ДДВФ) вызывали различный по выраженности и длительности антихолинэстеразный эффект у 16 исследованных видов рыб. Только в одном из известных нам сообщений автору [767] не удалось обнаружить отрицательного влияния фосфорорганического пестицида на активность АХЭ мозга рыб (ушастый окунь, сомик-кошка).
Сходство реакции рыб и теплокровных животных на фосфорорганические пестициды проявляется не только в самом факте ингибирования АХЭ мозга, но и в скорости развития этого эффекта. Снижение активности АХЭ мозга рыб происходит в первые часы контакта рыб с ядохимикатами задолго до летального исхода [841, 842, 494, 423, 3]. Выраженность антихолинэстеразного эффекта, вызываемого фосфорорганическими пестицидами, у рыб находится в прямой зависимости от концентрации ядохимиката и времени его действия [3]. Летальные концентрации фосфорорганичеоких пестицидов вызывают более глубокое угнетение АХЭ мозга рыб, чем сублетальные [496, 497]. Эти данные противоречат высказанной ранее [562] точке зрения о том, что не существует корреляции между концентрацией фосфорорганичеоких пестицидов и степенью угнетения активности АХЭ мозга рыб.
Разумеется, строгой корреляции между концентрацией и любым токсическим эффектом того или иного вещества ожидать нереально, поскольку токсикологи имеют дело с живыми организмами, исходное состояние которых определяется десятками факторов, и «уравнять» их практически невозможно. Тем не менее имеющиеся сегодня экспериментальные данные однозначно свидетельствуют о том, что высокие концентрации фосфорорганических пестицидов вызывают более глубокое и быстро наступающее угнетение активности АХЭ мозга рыб, чем более низкие.
Итак, фосфороргаиичеекие пестициды вызывают быстроразвивающееся угнетение активности АХЭ мозга рыб, но с более или менее длительным последействием. Восстановление исходного уровня активности АХЭ мозга в случае прекращения контакта рыб с пестицидом происходит в течение 8-30 сут [842, 748, 3].
Эти общие закономерности влияния фосфороргани-чееких пестицидов на АХЭ мозга рыб, выявленные экспериментальным путем, послужили основанием для использования фермента, уровня его активности в качестве биохимического критерия токсичности данной группы веществ и даже для оценки уровня загрязнения водных экосистем в США [493, 494]. Правда, возникли разногласия относительно того, где именно рассматривать активность ацетилхолинэстеразы: в мозг» или в плазме крови, но «и у кого не возникает сомнений в том, что активность этого фермента представляет собой чувствительный биохимический тест токсического действия фосов на рыб.
Изучение холинэстсразы крови рыб, отравленных различными фосфорорганическими пестицидами, началось практически одновременно с работами по АХЭ мозга. В одном из первых сообщений Р. Эйслера [539] показано, что при полуторамесячной экспозиции метилпаратион почти полностью угнетает холинэстеразу крови иглобрюха. Ингибпрование холинэстсразы крови рыб различными фосфорорганическим и пестицидами отмечали и другие авторы [761, 765, 564, 495]. Отечественные работы по этому вопросу стали проводиться в конце 60-х — начале 70-х годов. Согласно данным, опубликованным В. В. Метелевым [227], фоофорорганичеокие пестициды (метилвитрофос, фосфамид, трихлормета-фос-3) оказывают ингибирующее действие на активность АХЭ крови, а также печени и мышц некоторых видов рыб.
Так, субтоксическая концентрация фосфамида снижает активность АХЭ крови на 55%, а токсическая — на 72% (время наблюдений не указано). Метилнитрофос ингибирует этот фермент в крови на 62,9 и 68,8%, а в мышцах и в печени — на 100% (экспозиция 96 ч). Автор приходит к выводу, что отравление рыб фосфорорганическими пестицидами может быть диагностировано по степени угнетения АХЭ крови прижизненно, а печени и мышц — посмертно.
В работе Л. И. Грищенко и др. [71] представлены экспериментальные данные, свидетельствующие о наличии четко выраженной корреляционной зависимости антихолинэстразного эффекта одного из фосфорорганических пестицидов — бензофосфата — от концентрации вещества и времени его действия на рыб.
Острое отравление карпов (концентрация бензофосфата 1,2 мг/л) приводило к резкому (на 82%) снижению активности АХЭ крови уже через 3 ч. Интересные данные получены в подострых и хронических опытах. Концентрация 0,04 мг/л бензофосфата (1/30 ЛК50) вызывала угнетение АХЭ крови в течение 1 сут на 27,5%, 6 сут — на 49,0%, 30 сут — на 55,9% и 70 сут — на 74,1% активности АХЭ крови у контрольных рыб. Увеличение концентрации токсиканта до 0,06 мг/л (1/30 ЛК50) в те же сроки наблюдений привело к еще более резкому снижению активности фермента — на 48,3; 73,0; 85,0; 89,0% соответственно. Новое четырехкратное увеличение концентрации бензофосфата до 0,24 мг/л (1/30 ЛК50) вызвало уже через сутки ингибпрование активности АХЭ крови на 85,5%, через 6 сут — на 77%, через 15 сут — на 100% и через 30 сут — на 84,2%. Как при остром, так и при хроническом отравлении обнаружена тесная связь между степенью угнетения активности АХЭ крови и гибелью подопытных рыб.
Обстоятельное изучение динамики изменения активности АХЭ крови под влиянием ряда фосфорорганических пестицидов (базудин, байтекс, метафос, ДДВФ) выполнено II. Р. Косиновой [135].
Основным объектом исследования служил ка'рп. Длительность острых опытов 48 ч, хронических — 20-30 сут. Наиболее существенные изменения активности АХЭ крови отмечены на 5-е сутки. К этому сроку активность фермента у рыб, отравленных базудином (0,1 мг/л), составляла 68% контроля, байтексом — 85% и метафосом — 04%. Затем происходит иекоторое увеличение активности фермента (10-15-е сутки), которое сменяется вторичным угнетением иа 20-е сутки наблюдений. Автор отмечает наличие прямой коррелятивной связи между концентрацией препарата и его антнхолинэстразным эффектом. Снижение активности АХЭ отмечено также в печени и мышцах. И в том, и в другом случае оно менее выражено, чем в крови. Например, при ингибнровании фермента в крови на 40-50%, в печени и мышцах этих же рыб его активность снижается не более чем на 30%.
В работе В. И. Козловской и Г. М. Чуйко [121] предпринята попытка выявить наличие связи между общей устойчивостью рыб (лещ, синец, плотва и карп) к одному из фосфорорганических пестицидов — хлорофосу — и чувствительностью сывороточной холинэстеразы (шифр 3.1.1.8) к этому пестициду. Сама по себе такая постановка вопроса является несколько неожиданной. Ацетилхолинэстераза, по мнению С. Н. Голикова и В. Н. Розеигарт [62], «не является типичной для сыворотки крови», и потому даже полная инактивация этого фермента не должна повлечь за собой гибель организма. Еще в большей степени сказанное относится к сывороточной холинз-стеразе, функции которой вообще неясны даже у теплокровных животных, не говоря уже о рыбах. По-видимому, это «вспомогательный» фермент [282, 817], активность которого можно безболезненно снизить до нуля [320].
В серии опытов по идентификации авторы установили, что «холинэстеразы сыворотки крови карпа, леща, а также плотвы и синца с относительной электрофоретической подвижностью (ОЭП), равной 0,07, по своим свойствам ближе к ацетилхолинэстеразе, чем ферменты плотвы (ОЭП 0,26) и синца (ОЭП 0,29) — холинэстеразе» (121, с. 37). По данным опытов, большей чувствительностью к хлорофосу обладает фермент со свойствами холинэстеразы, имеющийся у плотвы и синца, устойчивость которых к хлорофосу (ЛК100 равна 60 и 70 мг/л соответственно) значительно ниже устойчивости карпа (ЛК100 равна 500 мг/л) и леща (ЛК100 равна 200 мг/л).
На основе этих данных авторы приходят к выводу, что «устойчивость изучаемых видов (плотва, лещ, синец, карп) коррелирует с чувствительностью их ферментов к токсиканту» [121, с. 39]. Однако нам такой вывод представляется неправомерным. Ведь у леща и карпа фермента со свойствами холинэстеразы нет, т. е. можно сказать, его активность нулевая, и они прекрасно обходятся без него. Почему же, например, у синца, систематически близкого лещу, снижение активности этого фермента должно послужить причиной гибели? Известно, что активность сывороточной холинэстеразы можно снизить до нуля без видимых патологических последствий [320]. Словом, удовлетворительного ответа на этот вопрос без исследований, направленных «а выяснение функций сывороточной холинэстеразы у рыб, получить нельзя. Что касается чувствительности другого сывороточного фермента — ацетилхолинэстеразы, то она у карпа и леща оказалась практически одинаковой. Между тем если судить по абсолютно летальной концентрации хлорофоса, то устойчивость карпа в 2,5 раза выше устойчивости леща. Более того, чувствительность ацетил-холинэстеразы к хлорофосу у плотвы и синца мало отличается от чувствительности ацетилхолинэстеразы у леща и карпа, а устойчивость плотвы и синца примерно в 7 раз ниже, чем у карпа, и в 3 раза ниже, чем у леща. Авторы игнорируют расхождения между степенью чувствительности ацетилхолинэстеразы у четырех видов карповых и степенью их устойчивости к хлорофосу. А ведь точкой приложения — «мишенью» фосфорорганических пестицидов является именно ацетилхолинэстераза.
Исследования показывают, что далеко не всегда имеется корреляция между степенью угнетения ацетилхолинэстеразы и холинэстеразы крови и выраженности интоксикации рыб, а тем более степенью устойчивости рыб.
Однако это обстоятельство, разумеется, не может служить помехой для использования активности ацетилхолинэстеразы крови в качестве чувствительного биохимического теста токсичности пестицидов. Сказанное в равной мере относится и к возможности использования АХЭ мозга, хотя и здесь отмечены случаи отсутствия корреляции между концентрацией пестицида и степенью ингибироваиия этого фермента [562]. Конечно, кровь доступнее для анализов, чем, скажем, мозг или печень, и ее можно исследовать на разных этапах эксперимента у одной и той же рыбы [761, 564], но при этом следует учитывать, что функциональное значение АХЭ мозга и крови далеко не равнозначно для организма. Поэтому мы считаем, что дискуссия относительно того, в каком органе или какой ткани исследовать активность АХЭ при отравлении рыб пестицидами, носит искусственный характер. Значительно более важно, на наш взгляд, оценить критерии токсичности этой группы веществ при исследовании уровня активности фермента, т. е. определить, какая степень угнетения АХЭ должна восприниматься как свидетельство выраженного токсического эффекта.
По мнению Д. Колледжа [493, 494], снижение активности АХЭ мозга на 13% по сравнению с активностью АХЭ мозга контрольных особей отражает токсическое действие пестицидов, а падение ее на 83% приводит к гибели рыб. Сходной точки зрения придерживается Г. Гольдштейи [564]. По его мнению, угнетение активности АХЭ в мозге рыб на 10%, в эритроцитах на 20% и в плазме крови на 33% может служить надежным показателем токсического действия пестицидов на рыб. Напомним, что и у теплокровных животных снижение активности АХЭ эритроцитов на 20-25% отражает развитие токсического процесса. По данным М. Али [3], угнетение активности АХЭ мозга рыб в первые часы контакта с пестицидами на 50% и более является показателем летального исхода в течение 10 сут, а на 30-40% — свидетельствует о развитии токсического процесса. Авторы еще одной работы, выполненной на карпе с токсафеном — одним из хлорорганических пестицидов [667], приходят к выводу, что угнетение АХЭ сыворотки крови на 20-30% указывает на легкую степень отравления рыб, на 50-60% — среднюю и на 80% — на тяжелую степень отравления. Далее мы вернемся к результатам этой работы. Совокупность накопленных к настоящему времени данных однозначно свидетельствует о возможности практического использования активности ацетилхолинэстеразы различных органов и тканей в качестве надежного биохимического критерия токсичности пестицидов, а также для прогностических целей. Остановимся еще на одном, весьма важном, на наш взгляд, вопросе о специфичности антихолинэстразного эффекта фосфорорганических пестицидов у рыб, представляющем не только теоретический, но и практический интерес. Как мы уже отмечали, в США антихолинэстеразное действие фосов используют не только для оценки степени токсичности того или иного пестицида фосфороргани ческой группы в лабораторных экспериментах, но даже для оценки уровня загрязнения, фосфороргаиичеокими пестицидами водных экосистем [761], т. е. как для биотестирования, так и для биоиндикации. Биотестирование фосфорорганических пестицидов в лабораторных условиях на рыбах с использованием такого чувствительного биохимического теста не вызывает возражений. Однако биоивдикация фосфорорганических пестицидов в естественных водоемах на основе одного лишь этого теста встречает серьезные затруднения. И дело не только в том, что уровень активности АХЭ мозга, крови и других органов и тканей у рыб природных популяций зависит от многих факторов, в том числе от температуры воды в водоеме, а потому широко варьирует [761]. Главная причина заключается в том, что изменение активности АХЭ рыб может быть вызвано и другими токсикантами. В 1963 г. [158, 185] было впервые показано снижение активности холинэстеразы мышечной ткани рыб, подвергшихся острому отравлению фенолом. Результаты этих опытов были впоследствии подтверждены на других видах рыб, отравленных фенолом, а также сернокислым аммонием и медью, причем исследовалась ацетилхолинэстераза мозга [715].
В настоящее время имеется довольно много экспериментальных данных, из которых следует, что активность АХЭ различных органов и тканей рыб может изменяться не только под влиянием фосфорорганических пестицидов, но и под действием других токсикантов, в том числе хлорорганических и карбаматных пестицидов.
Так, в работе В. Литбраски и Г. Литбраски [667] показано, что хлорорганический пестицид токсафен (полихлоркамфен) концентрацией 0,5 и 0,75 мг/л уже через 10 ч после начала опытов вызывал снижение активности АХЭ сыворотки крови карпа на 23-41%, а в эритроцитах — повышение ее на 27-53%. Другой хлорорганический гестицид — ДДТ вызывал угнетение активности АХЭ мозга окуней (на стадии агонии) почти на 50% по сравнению АХЭ мозга контрольных особей [206]. А. Я. Маляревской [206] удалось показать, что такие неспецифические стрессорные воздействия на организм, как гипоксии, приводят к резко выраженному снижению активности АХЭ мозга (па 82-87%) и печенп (на 71-89%) у окуней на стадии агонии. Наконец, синезеленые водоросли и их токсины также вызывают снижение активности АХЭ мозга (у судака на 54%, у язя на 31-63%, у карася на 21—33%, у толстолобика на 37%) и печени (у судака на 47%, у язя на 8-56%, у карася на 14-51%, у толстолобика на 26%). Анализируя полученные данные, А. Я. Малярсвская приходит к вполне обоснованному выводу о том, что угнетение активности холинэстсразы при воздействии перечисленных экстремальных факторов свидетельствует о неспецифичности изменения этого показателя и о возможности применения его для характеристики различных интоксикаций и разнообразных нарушений в организме рыб, связанных с изменением нормального функционирования нервной системы» [206, с. 106].
Влияние хлорорганических пестицидов на активность АХЭ различных органов и тканей отмечает и О. В. Маслова [221] у рыб, отловленных па загрязненных участках Дуная. Определяя наличие остаточных количеств хлорорганических пестицидов в организме рыб, в частности ДДТ, она обнаружила наличие прямой связи между содержанием ДДТ в органе и активностью АХЭ: чем больше ДДТ в том или ином органе рыб, тем ниже активность его АХЭ. Максимальное угнетение этого фермента обнаружено в мозге годовиков леща. Интересно, что активность АХЭ сыворотки крови рыб, в организме которых имеется ДДТ, либо вообще не меняется, либо увеличивается. Так, у хищных рыб из дельты Дуная активность АХЭ крови была достоверно выше (у судака на 63%, у окуня на 54%), чем у этих же видов, отловленных в более чистом Днепровско-Бугском лимане. Такая направленность изменений активности АХЭ сыворотки крови под влиянием хлорорганических пестицидов, отличающаяся от имеющей место при отравлении рыб фосфорорганическими пестицидами, вполне возможна. По нашим неопубликованным данным, полученным совместно с Л. А. Петуховой еще в 1963 г., в результате длительного (до 6 сут) действия сублеталыюй концентрации фенола (5 мг/л) на рыб активность АХЭ крови у подопытных лещей к концу наблюдений (9,79% разложенного ацетилхолина) была значительно выше, чем у контрольных (3,60%). Сегодня трудно дать однозначное объяснение обнаруженным различиям в изменении активности АХЭ сыворотки крови, вызванном фосфорорганическими пестицидами и друтими токсикантами (фенол, ДДТ). Одной из причин могут быть фазовые изменения активности фермента [135], когда первоначальное снижение активности АХЭ вменяется затем се повышением и стабилизацией на новом уровне с последующим резким снижением незадолго до гибели рыб.
Угнетение активности АХЭ мозга рыб отмечено и в опытах с карбаматными пестицидами [266,3], которые, как известно, выступают в роли конкурирующих ингибиторов, не соединяясь непосредственно с ферментом. В опытах М. А. Али [3], выполненных на карпе, изучено антихолинэстеразнос действие двух карбаматных пестицидов: севина и темика. Уже через 2 ч после помещения рыб в раствор севина концентрацией 5 мг/л активность АХЭ мозга карпа снизилась на 35%, к исходу 1-х суток — на 86%. Гибель рыб па-втупала на 3-й сутки при почти полном угнетении АХЭ (остаточная активность 8%).
В хронических опытах, длившихся 21 сут, снижение активности АХЭ под влиянием растворов севина концентрацией 0,01, 0,1 и 0,5 мг/л продолжалось в течение всего периода наблюдений, н к концу их она составляла 51, 32 и 22% соответственно. Судя по ингибирующему действию на АХЭ мозга, другой карбаматный пестицид — темик — оказался еще более токсичным, чем севин. Погружение рыб в растворы пестицида концентрацией 0,1, 0,25 и 0,5 мг/л привело через 2 ч к снижению активности АХЭ на 57, 65 и 78% соответственно. Гибель рыб в растворах концентрацией 0,1 мг/л произошла на 3-й сутки, а в растворе концентрацией 0,25 мг/л — на 6-е сутки при остаточной активности АХЭ мозга, равной 5 и 4% соответственно. В хронических опытах с минимальной концентрацией темика 0,001 мг/л к 21-му дню наблюдений активность АХЭ мозга составляла 40% контроля. Из этих данных следует, что карбаматные пестициды вызывают не менее выраженное и такое же скоротечное угнетение активности АХЭ мозга рыб, что и фосфорорганические пестициды.
Эти материалы показывают, что угнетение активности АХЭ мозга и крови рыб может быть вызвано не только фосфороргаиичеокими пестицидами, но и многими другими токсикантами (фенолы, аммоний; карбаматные и хлорорганические пестициды, синезеленые водоросли и их токсины). Следовательно, использовать этот биохимический показатель для оценки степени загрязнения водных экосистем фоефорорганичеоким'и пестицидами, т. е. для биоиидикации, можно лишь с большой осторожностью наряду с определением остаточных количеств этих пестицидов в рыбах [761, 493], исключив при этом наличие других токсикантов в воде и гидробионтах. Однако сделать это чрезвычайно трудно. Вместе с тем активность ацетилхолинэстеразы — фермента, характеризующего функциональное состояние нервной системы, может служить весьма чувствительным биохимическим индикатором токсичности различных групп веществ, обладающих нервно-паралитическим действием, и имеет прогностическое значение.
Аденозинтрифосфатазы
Среди полифосфатаз — ферментов, гидролизующих фосфорангидридные связи, особое место занимает аденозитрифосфатаза (АТФ-аза), осуществляющая ферментативный гидролиз важнейшего макроэргического соединения аденозинтрифосфата (АТФ), играющего главную роль в энергетическом режиме клетки. Значение ферментативного гидролиза АТФдля энергетического обеспечения различных биохимических процессов стало известно 40 лет назад [666], и с тех пор интерес исследователей к этому процессу нарастает. В начале 70-х годов АТФ-аза стала привлекать внимание токсикологов. Появились сообщения о том, что ведущим механизмом нейротоксического эффекта некоторых хлорорганических пестицидов, в частности ДДТ, следует считать снижение активности Na+, К+ и Mg++, активируемых АТФ-аз нервного волокна [642, 695, 621]. Поскольку АТФ-аза играет важную роль в обеспечении проницаемости биологических мембран для различных ионов, становятся понятными выявленные ранее изменения в соотношении ионов натрия и калия в нервном волокне, вызванные нарушением проницаемости клеточных оболочек для этих ионов под влиянием ДДТ. Напомним, что ионы натрия и калия имеют исключительно важное значение для регуляции обменных процессов в клетке. Изучение характера действия ДДТ и других пестицидов на активность АТФ-аз различных тканей рыб началось [643, 513, 506, 507, 658, 621, 622] практически одновременно с аналогичными исследованиями на теплокровных животных. В этих исходных исследованиях обнаружено ингибирующее действие хлорорганических пестицидав на АТФ-азы рыб, подобное имеющему место у теплокровных животных.
В серии работ [643, 513, 506, 507] продемонстрировано снижение активности Na+, К+, активируемых АТФ-аз, а также Mg++ активируемой АТФ-азы мозга рыб под влиянием хлорорганических пестицидов (ДДТ, токсафен, дикофол, эндосульфан). Эти данные, полученные in vitro, были впоследствии подтверждены и расширены за счет использования новых видов рыб и новых пестицидов хлорорганического ряда; длительный (266 сут) контакт подопытных рыб (Pimaphales promeles) с ДДТ концентрацией 2 мкг/л привел к снижению активности митохондриалыюй Mg+-АТФ-азы мозга на 50% в сравнении с нормальной активностью. В то же время отмечено увеличение активности нечувствительной к олигомицину АТФ-азы на 40 % и Na+K+ АТФ-аз на 28 % в сравнении с их активностью у контрольных особей [521, 508]. Активация Mg++ активируемой АТФ-азы митохондрий мозга форели отмечена в опытах с малыми концентрациями ДДТ, однако более высокие его концентрации в большей степени снижают активность нечувствительной к олигомицину Mg++-АТФ-азы в сравнении с чувствительной [618, 619].
Угнетение активности Na+, К+ и Mg++ активируемых АТФ-аз микросомальных фракций мозга под влиянием ДДТ отмечено еще у одного вида рыб (Ictalurus punctatus) [520]. Помимо уже указанных хлорорганических пестицидов (ДДТ, токсафен, дикофол, эндосульфан) ингибирующим действием на зависимые АТФ-азы мозга рыб обладают также кспон, дильдрин и альдрин [864, 521].
Согласно современным представлениям АТФ-азы имеют важное значение для ионной и осмотической регуляции, играя роль своеобразного натриевого насоса у пресноводных рыб [745, 386]. Напомним, что основным элементом осморегуляции пресноводных рыб является активный транспорт натрия и хлора через жабры из воды во внутреннюю среду [61. 246, 492].
Ведущую роль в этом процессе играет проницаемость жаберного эпителия для воды и солей, которая собственно и регулируется локализованными в жабрах Na+, К+ и Mg++ активируемыми АТФ-азами. Уровень активности этих ферментов в жабрах, а также в почках у рыб определяет интенсивность и направленность транспорта ионов и воды [544]. В связи с этим закономерен интерес ихтиотоксикологов к изучению влияния токсикантов на активность АТФ-аз, локализованных в жабрах и почках. Уже в первых работах, выполненных на различных видах морских рыб [621, 622, 710], и радужной форели [513, 658], продемонстрировано угнетающее действие ряда хлорорганических пестицидов на активность АТФ-аз жабр, почек, а также тонкого кишечника. Так, снижение активности Na+, К+ активируемых АТФ-аз жабр и почек радужной форели происходит под влиянием ДДТ, эндосульфана и дикофола [513]. Интересные данные получены в опытах с ДДТ на радужной форели, адаптированной предварительно к морской и пресной воде [658]. У рыб, адаптированных к морской воде, угнетение Na+, К+ активируемых АТФ-аз, вызванное ДДТ, сопровождается нарушением осморегуляции, вследствие чего в крови увеличивается содержание ионов натрия. У форели, адаптированной к пресной воде, снижение активности ферментов менее выражено, а нарушения осморегуляции не происходит. Однако у пресноводного карася (Carassius auralus) длительное воздействие ДДТ приводило к снижению концентрации ионов натрия и общей осмолярности крови [840].
Торможение активности Na+, К+ активируемых АТФ-аз в жабрах, почках и кишечнике под влиянием ДДТ отмечено и в опытах с другими видами рыб: Pseudopleuronectes-americanus [621], Anguilla rostrata [622], Fundulus heteroclitus [711], Pimephales promelas [521].
Угнетение активности Na+, К+-АТФ-азы и нарушение осморегуляции у морской карпозубой рыбы (Fundulus heteroclitus) и пнмефала (Pimephales promeles) вызывают также полихлорированные бифеннлы [710, 643].
Обобщая имеющиеся экспериментальные данные, можно сделать вывод, что многие хлорорганические пестициды вызывают четко выраженное торможение активности Na+, К+ и Mg++ активируемых АТФ-аз мозга, жабр, почек у морских, пресноводных и проходных рыб. Это дает основание считать, что уровень активности АТФ-аз может служить важным биохимическим показателем токсического действия хлорорганических соединений. Не исключено, что и другие токсические вещества оказывают ингибирующее действие на АТФ-азы рыб, но это не может служить препятствием для их практического использования в ихтиотоксикологических исследованиях.
 2020-05-12
2020-05-12 149
149








