Микробиологическая диагностика позволяет поставить или подтвердить клинический диагноз инфекционного заболевания, определить источник инфекции и чувствительность возбудителя к антибактериальным препаратам.
В микробиологической лаборатории используют различные методы диагностики:
— микроскопический;
— культуральный;
— биологический;
— серологический;
— аллергологический;
— молекулярно-генетический.
Микроскопический метод - обнаружение микроорганизмов в препаратах из исследуемого материала и их первичная морфологическая идентификация. Микропрепараты могут быть нативными (изучаются микроорганизмы в живом состоянии), при этом можно определить подвижность исследуемых объектов. Изучение таких препаратов осуществляется в затемненном поле зрения светового микроскопа, а также с помощью темнопольной и фазово-контрастной микроскопии.
Исследование фиксированных и окрашенных различными методами препаратов дает возможность определить расположение микроорганизмов в препарате, их размеры, компоненты клетки, отношение к окраске. Микроскопическая техника может быть различной: световой, люминесцентный, электронный микроскопы и др.
Световая микроскопия из-за ничтожно малых размеров вирусов при исследовании вируссодержащего материала практически не применяется. С помощью светового микроскопа можно выявить внутриклеточные включения, которые образуются в пораженных клетках при некоторых вирусных инфекциях. В этом случае чаще всего используют электронный микроскоп, реже - люминесцентный. Световой микроскоп можно применять лишь для обнаружения крупных вирусов, используя методы сверхокраски.
Микроскопический метод чаще используют как ориентировочный, так как микроорганизм не всегда можно идентифицировать по морфологическим признакам.
Культуральный метод - посев исследуемого материала на питательные среды, куриные эмбрионы, культуры клеток для выделения чистой культуры возбудителя и его идентификации. Этот метод является «золотым стандартом» микробиологического исследования, потому что позволяет успешно выделить и идентифицировать возбудителя, хотя и является дорогостоящим, трудоемким и длительным (проводится в течение 3-5 дней, а иногда и более). Данный метод проводят в следующих вариантах. - Бактериологический метод - выращивание бактериальной культуры, которую идентифицируют по морфологическим, тинкториальным, культуральным, биохимическим и антигенным свойствам. При необходимости этот метод позволяет провести эпидемиологическое маркирование и определить чувствительность к антибиотикам. Иногда перед посевом проводят первичную микроскопию исследуемого материала (это необязательный этап). Моча, кровь, фекалии, мазки из зева и носа первичной микроскопии не подлежат. Гной, спинномозговая жидкость, мокрота (в разведении 10 4-10 5) подлежат микроскопии перед посевом, так как микроскопия помогает выбрать среды для посева. Выделение чистой культуры проводят в несколько этапов:
◊ 1-й этап - посев исследуемого материала методом, позволяющим получить рост отдельных колоний;
◊ 2-й этап - проверка роста колоний на питательной среде и изучение их культуральных свойств (величины, цвета, формы колоний, их прозрачности, характера поверхности, однородности структуры). Изучение культуральных свойств заканчивается приготовлением мазка из колонии и окраской его по Граму, определяя при этом морфологические и тинкториальные свойства бактерии. После этого проводят пересев на скошенный агар или чашку Петри для накопления чистой культуры;
◊ 3-й этап - проверка чистоты накопленной культуры (готовят мазок, окрашивают его по Граму и микроскопируют). Если накопленная культура чистая, ее идентифицируют по биохимическим свойствам и антигенной структуре. Для биохимической дифференциации используют дифференциально-диагностические среды, содержащие различные субстраты. Сахаролитические свойства изучают на средах Гиса, которые изменяют свою окраску в случае ферментации сахара бактерией и выделения при этом кислоты, которая изменяет окраску индикатора. О способности расщепления белков судят по разжижению желатины; продуктами распада белков также являются индол, сероводород и аммиак, выделения которых фиксируют с помощью изменения окраски индикаторных бумажек, например, пропитанной индолом, щавелевоуксусной кислотой, сероводород - уксуснокислым свинцом, аммиак - лакмусовой бумажкой;
◊ 4-й этап - оценка результатов биохимических исследований и определение таксономического положения микроорганизма, что является основой антигенной идентификации.
— Микологический метод используют при культивировании грибов; посев исследуемого материала проводят на специальную среду Сабуро.
— Протозоологический метод (паразитологический) применяют при выделении простейших.
— Вирусологический метод используют при работе с вируссодержащим материалом. Метод заключается в выделении вирусов при заражении исследуемым материалом лабораторных животных, куриных эмбрионов, культур клеток с последующими индикацией вируса в зараженном объекте и его идентификацией.
Биологический метод (экспериментальный, биопроба) - выделение чистой культуры при заражении экспериментальных животных с последующими высевом крови, секционного материала на питательные среды, выделением чистой культуры и ее идентификацией. Этот метод позволяет определить факторы патогенности микроорганизма, летальную дозу, тип токсина, вырабатываемого микроорганизмом.
Серологический метод основан на выявлении АТ в сыворотке крови (а также в слюне и других биологических жидкостях больного) с помощью известных бактериальных АГ. Этот метод позволяет определить количество (титр) АТ и течение инфекционного процесса по нарастанию титра АТ, а также стадию заболевания. Для этого определяют класс Ig. Обнаружение специфических Ig класса М свидетельствует об острой инфекции. При диагностике некоторых инфекций (гепатита В) определяют АГ микроорганизмов в материале от больного.
Особенностью серологического метода в вирусологии является исследование парных сывороток. Первую сыворотку берут у больного в острый период, в начале болезни, и хранят при температуре 4-8 °C, а вторую сыворотку - через 10-14 дней. Сыворотки исследуют одномоментно. О болезни свидетельствует сероконверсия, т.е. нарастание титра АТ во второй сыворотке по отношению к первой. Диагностической является сероконверсия в 4 раза и выше. В связи с тем что многие вирусные болезни протекают остро, этот вариант серологического метода обычно применяют для ретроспективной диагностики.
Аллергологический метод основан на выявлении повышенной чувствительности к бактериальному аллергену. С этой целью проводят кожно-аллергические пробы с диагностическими аллергенами.
Молекулярно-генетический метод основан на идентификации возбудителя в исследуемом материале путем определения нуклеотидных последовательностей с помощью ПЦР, молекулярной гибридизации, микрочипа и других методов молекулярной биологии.
— Полимеразная цепная рекция позволяет обнаружить микроорганизм в исследуемом материале (воде, продуктах, материале от больного) по наличию в нем ДНК микроорганизма без выделения последнего в чистую культуру. Для проведения ПЦР из исследуемого материала выделяют ДНК, а наличие возбудителя определяют по обнаружению в выделенной ДНК специфичного для искомого микроорганизма гена. Обнаружение гена осуществляют его накоплением. Для этого требуются праймеры (затравки), комплиментарные ДНК искомого гена. Накопление (амплификацию) гена выполняют следующим образом. Выделенную из исследуемого материала ДНК нагревают. При этом ДНК распадается на две нити. Добавляют праймеры, смесь ДНК и праймеров охлаждают. При этом праймеры при наличии в смеси ДНК искомого гена связываются с его комплиментарными участками. Затем к смеси ДНК и праймера добавляют ДНК-полимеразу и нуклеотиды. Устанавливают температуру, оптимальную для функционирования ДНКполимеразы. В этих условиях в случае комплементарности ДНК гена и праймера происходит присоединение нуклеотидов к З'-концам праймеров, в результате чего синтезируются две копии гена. После этого цикл повторяется снова, при этом количество ДНК гена будет увеличиваться каждый раз вдвое (рис. 9.1). Реакцию проводят в специальных приборах - амплификаторах. Результат оценивается последующими денситометрией амплифицированной ДНК или ее электрофорезом в полиакриламидном геле. ПЦР применяют для диагностики вирусных и бактериальных инфекций.
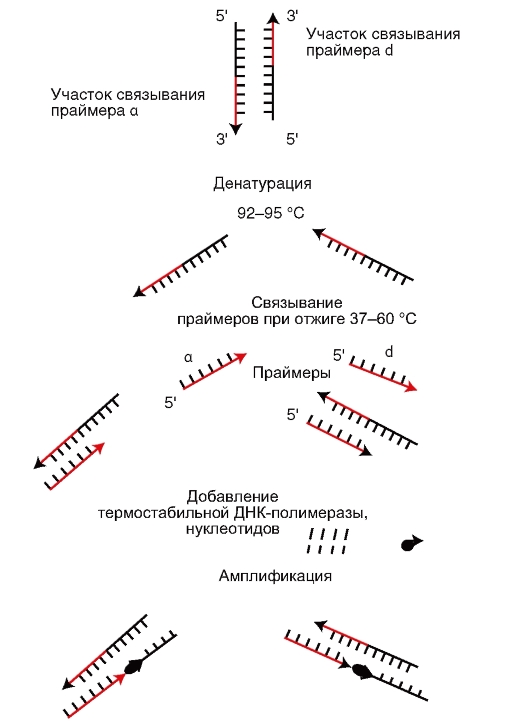
Рис. 9.1. Полимеразная цепная реакция (схема)
— Молекулярная гибридизация позволяет выявить степень сходства различных ДНК. Применяют при идентификации микроорганизмов для определения их точного таксономического положения, а также для их обнаружения в исследуемом материале без выделения в чистую культуру. Метод основан на способности двухцепочечной ДНК при повышенной температуре (90 °C) в щелочной среде денатурировать, т.е. расплетаться на две нити, а при понижении температуры на 10 °C вновь восстанавливать исходную двухцепочечную структуру. Метод требует наличия молекулярного зонда - одноцепочечной молекулы нуклеиновой кислоты, меченной радиоактивными нуклидами, ферментом, флюорохромным красителем, с которой сравнивают исследуемую ДНК. Для проведения молекулярной гибридизации исследуемую ДНК расплетают указанным выше способом, одну нить закрепляют на специальном фильтре, который затем помещают в раствор, содержащий зонд. Создают условия, благоприятные для образования двойных спиралей. При комплиментарности между зондом и исследуемой ДНК они образуют между собой двойную спираль, наличие которой определяют следующими методами в зависимости от типа метки зонда: подсчетом радиоактивности, иммуноферментным анализом или денситометрией.
— Определение микроорганизма в исследуемом материале с помощью микрочипа. Микрочип представляет собой стеклянную пластинку, к которой прикреплены молекулярные ДНКзонды, специфичные к определенным микроорганизмам. Из исследуемого образца выделяют общую ДНК, связывают ее с флюорохромом или ферментом и обрабатывают ею микрочип, создавая условия для гибридизации. Затем отмывают не связавшуюся ДНК и определяют локализацию молекулярных гибридов постановкой ИФА или денситометрией.
9.2. СБОР, ХРАНЕНИЕ И ТРАНСПОРТИРОВКА МАТЕРИАЛА ДЛЯ ИССЛЕДОВАНИЯ
В большой степени результаты микробиологического исследования зависят от соблюдения правил забора материала. Нарушения правил забора, неправильная и несвоевременная доставка материала в лабораторию отрицательно влияют на результаты исследования.
Вид материала для исследования определяется клинической картиной заболевания. Основные правила взятия материала включают следующие положения:
— материал по возможности берут непосредственно из очага инфекции;
— материал берут до начала лечения антибиотиками и исключают возможность попадания в него антибактериальных препаратов;
— взятие материала необходимо проводить в асептических условиях (кровь берут из локтевой вены после тщательной обработки кожи 70% этанолом с последующим протиранием места укола йодным раствором; при заборе мокроты больной должен почистить зубы и прополоскать рот слабым раствором антисептика; перед забором мочи необходимо провести тщательный туалет наружных половых органов с мылом и кипяченой водой);
— после взятия материал нужно в кратчайшие сроки доставить в лабораторию, соблюдая условия хранения и транспортировки (табл. 9.1). Оптимален первичный посев в месте взятия материала. Доставляют материал в специальных контейнерах, биксах, сумках-холодильниках. Необходимо учитывать, что при длительном хранении происходят гибель наиболее требовательных к условиям культивирования микроорганизмов и размножение менее требовательной сопутствующей микрофлоры;
— при взятии материала необходимо строго соблюдать меры безопасности при работе с клиническим материалом для микробиологического исследования;
— материал забирают в достаточном количестве, обеспечивающем необходимый для исследования объем. К исследуемому материалу, направляемому в лабораторию, прилагают сопроводительный документ, в котором указывают фамилию, имя, отчество больного, время взятия материала, предполагаемый диагноз.
Таблица 9.1. Забор, хранение и транспортировка материала для микробиологического исследования
| Материал для исследования | Условия хранения | Условия транспортировки |
| Кровь (10-30 мл венозной крови) | Не более 2 ч при комнатной температуре | В стерильных транспортных емкостях со средой, содержащей нейтрализаторы антибиотиков, или в шприце (5-10 мл крови, перемешанной с гепарином) |
Окончание табл. 9.1
| Материал для исследования | Условия хранения | Условия транспортировки |
| Спинномозговая жидкость | При 37 °C, избегая охлаждения, не более 15 мин | В стерильных пробирках с завинчивающейся крышкой или в шприце, на иглу которого надета стерильная резиновая пробка |
| Мокрота | В холодильнике 2-3 ч при 4 °C | В стерильной одноразовой емкости с завинчивающейся крышкой для сбора мокроты |
| Гнойное отделяемое | Не более 2 ч при комнатной температуре | В стерильной сухой пробирке или емкости с транспортной средой, в которую вмонтирован одноразовый зонд-тампон. В стерильной транспортировочной емкости со средой для анаэробов. В шприце, на обработанную 70% спиртом иглу которого надета стерильная резиновая пробка |
| Моча (средняя порция утренней, свободно выпущенной мочи) | Не более 2 ч при комнатной температуре и не более 8 ч в холодильнике при 4 °C | В стерильной одноразовой емкости с завинчивающейся крышкой для сбора мочи |
| Фекалии | Не более 2 ч при 4 °C в холодильнике | В пробирках с консервирующим раствором или в стерильной одноразовой емкости с завинчивающейся крышкой |
| Желчь | Не более 2 ч при 37 °C | В пробирках с фракциями желчи, которые необходимо держать в строго вертикальном положении |
9.3. СОВРЕМЕННЫЕ ТЕХНОЛОГИИ, ПРИМЕНЯЕМЫЕ В МИКРОБИОЛОГИЧЕСКОЙ ДИАГНОСТИКЕ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ
В настоящее время для биохимической идентификации бактерий часто вместо дифференциально-диагностических сред используют готовые тест-системы (рис. 9.2). Они представляют собой полистироловые или картонные планшеты с лунками, куда помещены сухие дифференциально-диагностические среды или субстраты, на которые должен подействовать искомый бактериальный фермент. Идентификацию выделенной чистой культуры в тест-системах проводят следующим образом:
— из выделенной чистой культуры готовят бактериальную суспензию в физиологическом растворе или в прилагаемом буфере;
— проводят инокуляцию приготовленной суспензии в лунки планшета;
— инкубируют (обычно при температуре 37 °C в течение 18-24 ч);
— оценивают результат по изменению окраски дифференциально-диагностических сред в планшете.

Рис. 9.2. Тест-система для биохимической идентификации бактерий
Научно-технический прогресс в области медицины привел к значительному усовершенствованию лабораторных диагностических технологий. В микробиологии технологическая революция привела к созданию автоматизированных систем идентификации микроорганизмов, индикации их минимальных количеств в патологическом материале с помощью иммуноферментных, молекулярных и цитометрических методов диагностики.
Так, например, разработаны системы идентификации микроорганизмов и определения их чувствительности к антибиотикам, основанные на использовании различных типах диагностических планшетов. Идентификация бактерий основана на фотометрической регистрации результатов биохимических реакций на тест-планшетах с последующей компьютерной обработкой данных с помощью программного обеспечения. Прибор состоит из фотометра, инкубатора, распределителя и компьютера с программным обеспечением. Из исследуемой колонии, выросшей на агаре, готовят суспензию, которая восьмиканальным дозатором быстро распределяет необходимый объем материала по планшетам. После заполнения и инкубации планшеты данные считываются многоканальным фотометром. Результаты обрабатываются программой, заложенной в компьютере, и распечатываются на принтере (рис. 9.3).

Рис. 9.3. Компьютерная тест-система для идентификации микроорганизмов
Проточные цитометры позволяют определить как общее количество бактериальных тел, находящихся в образце, так и количество жизнеспособных бактерий и грибов, присутствующих среди них. Принцип определения основан на избирательном окрашивании микрорганизмов с помощью специальных красителей.
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Назовите метод микробиологической диагностики, позволяющий установить вид возбудителя.
2. Назовите метод диагностики, который позволяет обнаружить возбудителя в исследуемом материале без выделения чистой культуры.
3. Протекание инфекционного процесса можно оценить по........
 2020-05-11
2020-05-11 1607
1607
