1.длина -расстояние между ядрами двух химически связанных атомов.
2.полярность – способность электронного облака, являющегося результатом образования химической связи между атомами, изменять свою форму при внешнем воздействии.
3.энергия химической связи – минимальное количество энергии, которое необходимо затратить на разрыв связи. Чем больше длина связи между атомами, тем меньше энергия связи, и наоборот.
4. валентный угол – угол между воображаемыми прямыми, проходящими через центры атомов, участвующих в образовании химической связи.
Составление электронных формул молекул простых веществ неметаллов:
УРОК № 55 ХИМИЯ 8 класс
Но молекулы могут образовывать и разные ато
Составление электронных формул молекул простых веществ неметаллов:
•• ••
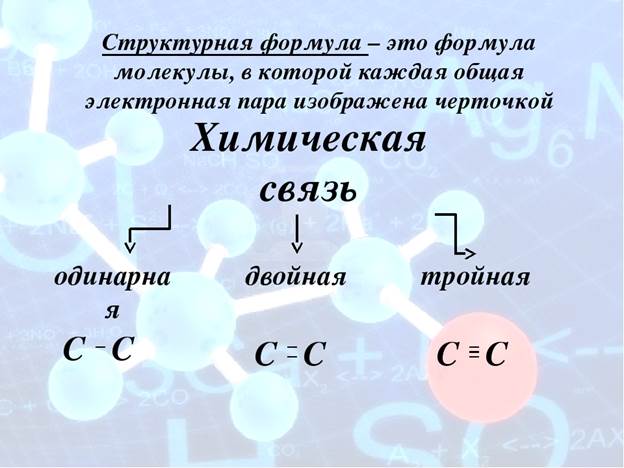
•• CI •• CI •• - электронная формула молекулы хлора,
•• ••
CI -- CI - структурная формула молекула хлора.
••
•• N •• N •• - электронная формула молекулы азота,
••
N ≡ N - структурная формула молекулы азота.
Составление электронных формул молекул йодоводорода и воды:
••
H •• J •• - электронная формула молекулы йодоводорода,
••
H → J - структурная формула молекулы йодоводорода.
••
H •• O •• - электронная формула молекулы воды,
••
H
Н →О - структурная формула молекулы воды.
↑
Н
ДОМАШНЕЕ ЗАДАНИЕ: 1. выучить конспект
2. Определите тип химической связи в соединениях:
Cl2 HBr CCl4 O3 F2 PCl5 HF S8
Cоставьте электронные и структурные формулы молекул веществ и
укажите тип связи Br2; NH3

 2020-05-11
2020-05-11 311
311







