Химия
А класс
Тема: Углеводы. Классификация углеводов. Моносахариды. Глюкоза. Строение молекулы глюкозы.
Углеводы – органические соединения, состав которых выражается общей формулой Cn(H2O)m. n и m обычно ≥ 4.
Углеводы являются очень распространенными соединениями в природе, входят в состав растений и организмов животных. В растениях образуются в результате фотосинтеза. Содержание углеводов в растениях до 80% массы сухого вещества, в организме человека и животных – до 20%. Пища человека на 70% состоит из углеводов.
Углеводы делят на 3 группы:
1. Моносахариды – их молекулы содержат от 3 до 10 атомов углерода. Название моносахаридов заканчивается на –оза. В зависимости от количества атомов С моносахариды делят на триозы, тетрозы пентозы, гексозы и т.д. важнейшие представители – глюкоза и фруктоза.
2. Олигосахариды – продукты конденсации 2 или нескольких молекул моносахаридов. Наибольшее значение имеют продукты конденсации 2 молекул моносахаридов (дисахариды). Самым известным представителем является сахароза.
3. Полисахариды – являются полимерами углеводов. Имеют очень большую молекулярную массу (ок. 100 000). Самые известные представители – крахмал и целлюлоза.
Моносахариды
Известнейшими предствавителямимоносахаридов являются глюкоза и фруктоза.
Глюкоза (виноградный сахар) – белое кристаллическое вещество, сладкое на вкус, хорошо растворимо в воде.
Строение молекулы глюкозы.
Глюкоза имеет суммарную формулу С6Н12О6. В развернутом виде ее молекула имеет вид:
СН2ОН – СНОН – СНОН – СНОН – СНОН – СОН, то есть, как видно из формулы, в глюкозе есть 5 гидроксогрупп ОН (многоатомный спирт) и 1 альдегидная группа СОН. То есть глюкоза является альдегидоспиртом. Пространственное строение молекулы глюкозы можно записать следующим образом:
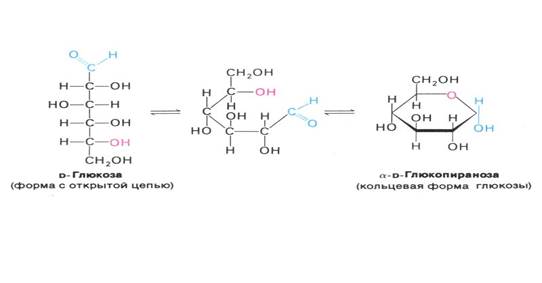
Глюкоза может образовывать и так называемые циклические формы (α и β) молекул. Циклическое строение молекулы глюкозы имеют в кристаллическом состоянии, а в водных растворах глюкоза существует в различных формах, которые взаимно превращаются друг в друга:
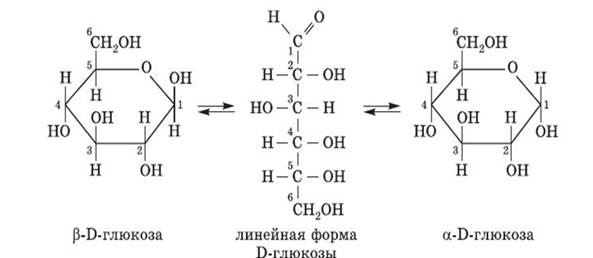
Химические свойства открытой формы глюкозы:
Свойства, характерные для многоатомных спиртов
1. Взаимодействие с карбоновыми кислотами с образованием сложных эфиров
С6Н7О(ОН)5 + 5СН3СООН = 5Н2О + С6Н7О(-О-СО-СН3)5 – пентаацетат глюкозы
2. Взаимодействие с гидроксидом меди (II) без нагревания с образованием ярко-синего раствора:
O
⁄ \
С6Н7О(ОН)5 + Сu(OH)2 = 2H2O + С6Н7О(ОН)3 Cu – глюкозид меди
\ ⁄
O
Свойства, характерные для альдегидов
1. Реакция «серебряного зеркала»
СН2ОН –(СНОН)4 – СОН + Ag2O = 2Ag↓ + СН2ОН – (СНОН)4 – СОOН – глюконовая кислота
2. Взаимодействие при нагревании с гидроксидом меди (II) при нагревании с образованием красного осадка:
СН2ОН – (СНОН)4 – СОН+ 2Cu(OH)2 =СН2ОН – (СНОН)4 – СОOН + 2H2O + Cu2O–красный
Особые свойства
1. Постепенное окисление в организме с медленным выделением энергии:
С6Н12О6 + 6О2 = 6СО2 + 6Н2О + Q
2. Брожение
a) Спиртовое
С6Н12О6 = 2СО2↑ + 2С2Н5ОН - этанол
b) Молочнокислое
С6Н12О6 = 2СН3-СНОН-СООН – молочная кислота
c) Маслянокислое
С6Н12О6 = 2СО2↑+ 2Н2↑ + С3Н7СООН – масляная кислота
Получение глюкозы
1. Гидролиз крахмала
(C6H10O5)n + nH2O → nC6H12O6 – при нагревании с серной кислотой
2. Синтез Бутлерова (получение из метаналя)
Ca(OH)2
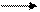 6HCOH C6H12O6
6HCOH C6H12O6
Применение глюкозы
1. В медицине для лечения дистрофии
2. В кондитерском деле
3. Для производства пива
4. При квашении капусты, молока, силосовании кормов
5. Как восстановитель в текстильной промышленности.
Изомером глюкозы является фруктоза. По структуре фруктоза в отличие от глюкозы (альдегидостпирта) является кетоноспиртом. Вместе с глюкозой содержится в меде и сладких плодах.
Олигосахариды
Важнейшее значение среди олигосахаридов имеют дисахариды, в частности, сахароза (свекловичный или тростниковый сахар) С12Н22О11
Физические свойства – белое кристаллическое вещество, слаще глюкозы, хорошо растворимо в воде.
Химические свойства:
1. Подвергается кислотному гидролизу
С12Н22О11 + Н2О = С6Н12О6(глюкоза) + С6Н12О6(фруктоза)
2. Не вступает в реакцию серебряного зеркала
3. Взаимодействует с гидроксидом меди (II) без нагревания с образованием ярко-синего раствора
4. Не имеет восстановительных свойств.
Полисахариды
К ним относят крахмал и целлюлозу. Молекулярная масса очень велика (больше 100 000). Формулу записывают в виде (С6Н10О5)n, т.е.являются полимерами.
Крахмал – полимер, звеньями которого являются остатки циклической α-глюкозы. N–от сотен до 5000. Молекулы могут иметь как линейное, так и разветвленное строение, поэтому структура крахмала – зернистая. Физические свойства – белый порошок, нерастворим в воде, в горячей воде набухает. Химические свойства – гидролизует при нагревании в присутствии серной кислоты, образуя молекулы глюкозы; при взаимодействии с йодом дает синее окрашивание. Применение – как продукт питания; для получения патоки; для приготовления клея и обработки тканей; в производстве этилового спирта; в медицине при изготовлении мазей, присыпок.
Целлюлоза – полимер с такой же формулой, как и крахмал, но число nу целлюлозы гораздо больше, чем у крахмала – до 40 000. Молекулы имеют только линейное строение, чем объясняется волокнистость. Физические свойства – волокнистое вещество, не растворимо в воде и органических растворителях. Химические свойства – как и крахмал, подвергается кислотному гидролизу с образованием β-глюкозы; способна к реакциям этерификации при взаимодействии с азотной кислотой (образуются динитро- и тринитроцеллюлоза); горит с образованием углекислого газа и воды; разлагается без доступа возлуха, образуя метан, ацетон, метанол, уксусную кислоту.Применение – в составе древесины в строительстве; в составе волокон для изготовления тканей и ниток; для изготовления бумаги; для получения этанола и каучука; для производства искусственных волокон, кинопленки, лаков, пороха.
Домашнее задание:
1. Выучить § учебника «Углеводы», конспект
2. Написать уравнения реакций согласно схеме:
Метан → метаналь → глюкоза → этанол → уксусная кислота
3. Решить задачу: Какой объем воздуха, содержащего 21% кислорода, необходим для полного окисления 126 кг глюкозы?
 2020-05-11
2020-05-11 130
130






