1) на одной орбитали могут находиться только ДВА электрона, которые вращаются вокруг своей оси в противоположных направлениях.
2) в пределах подуровня орбитали заполняются одиночными электронами с параллельными спинами, и когда все орбитали данного подуровня будут заняты, происходит спаривание последних (в одной клетке стрелке всегда противоположно направлены)
3) Электроны располагаются согласно принципу наименьшей энергии.
Используя для обозначения уровня арабские цифры и обозначая орбитали буквами, а число электронов данной орбитали цифрой вверху справа над буквой, изображаем строение атомов более полными электронными формулами.
Пример:
1) Порядковый номер водорода 1. Ядро атома водорода имеет заряд +1, поэтому вокруг его ядра движется только один электрон. Номер периода 1, поэтому электрон находится на единственном энергетическом уровне.
H +1)1e – схема строения атома, отображает распределение электронов по уровням.
+1 Н 1s1 – электронная формула, отображает число электронов и распределение их по орбиталям.
| ↑ |
+1 Н - графическая формула – показывает распределение электронов по орбиталям и отображает спин электрона.
2) Номер натрияравен 11. Ядро атома кремния содержит 11 протонов, поэтому его заряд +11. Электронов также 11. Номер периода 3, потому электроны распределены на трёх энергетических уровнях:
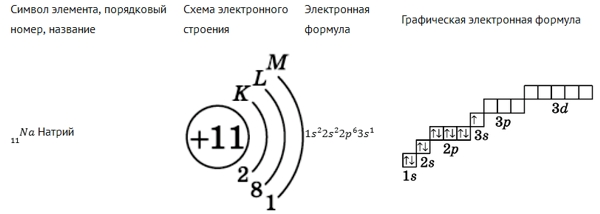


Так как число электронов на внешнем уровне равно номеру группы, то для элементов одной группы наблюдается повторение строения внешнего слоя. А значит и схожесть их свойств.
Скажем, аргон и неон содержат на внешнем уровне по восемь электронов, и потому они инертны, то есть почти не вступают в химические реакции. В свободном виде аргон и неон – газы, которые имеют одноатомные молекулы.
Атомы лития, натрия и калия содержат на внешнем уровне по одному электрону и обладают сходными свойствами, поэтому они помещены в одну и ту же группу периодической системы.
Выводы:
1. Свойства химических элементов, расположенных в порядке возрастания заряда ядра, периодически повторяются, так как периодически повторяется строение внешних энергетических уровней атомов элементов.
2. Плавное изменение свойств химических элементов в пределах одного периода можно объяснить постепенным увеличением числа электронов на внешнем энергетическом уровне.
3. Причина сходства свойств химических элементов, принадлежащих к одному семейству, заключается в одинаковом строении внешних энергетических уровней их атомов.
 2020-05-25
2020-05-25 372
372







