Электроны, двигаясь вокруг ядра атома, образуют его электронную оболочку.
Электрон вращается вокруг ядра атома с невообразимой скоростью. Так, за 1 секунду он делает столько оборотов вокруг ядра атома, сколько оборотов делает пропеллер самолета вокруг оси за 5–5,5 лет непрерывной работы двигателя.
Пропеллер самолета образует «облако», находящееся в одной плоскости, а электрон образует объемное облако – электронное облако, форма и размер которого зависят от энергии электрона.
Электронное облако – это модель (образ), которая описывает движение электрона
в атоме.
Электронное облако не имеет строго очерченных границ и плотность его неравномерна.
Часть пространства, в котором вероятность нахождения электрона наибольшая
(~90%), называетсяорбиталью.
Орбиталь обозначают клеточкой:

Условное обозначение электрона – стрелка, направленная вверх ↑ (электрон вращается вокруг собственной оси по часовой стрелке) или стрелка, направленная вниз ↓ (электрон вращается вокруг собственной оси против часовой стрелки).
В одной орбитали могут разместиться только ДВА электрона, которые вращаются в противоположных направлениях (по часовой стрелке и против часовой стрелки) – электроны с противоположными спинами (от англ. вращать):
| ↑↓ |
Важнейшей характеристикой электрона является энергия его связи с ядром. Одни электроны притягиваются к ядру сильнее, другие слабее. Чем ближе электроны к ядру, тем больше связь их с ядром, но меньше энергия. Чем дальше от ядра, тем сила притяжения электрона к ядру уменьшается, а энергия увеличивается. Так образуются электронные слои в электронной оболочке атома.
Электроны, обладающие близкими значениями энергии, образуют единый электронный слой, или энергетический уровень.
Условное обозначение энергетического уровня - скобка:)
Число энергетических уровней определяют по номеру периода, в котором находится химический элемент: у водорода (Н) номер периода 1, поэтому у него – 1 уровень, у кислорода – 2 период и уровней два, магний – три уровня.

Максимальное число электронов, которое может находиться на том или ином энергетическом уровне, определяется по формуле:
N = 2n2, где N – максимальное число электронов на уровне;
n – номер энергетического уровня.
Установлено, что:
на первой оболочке располагается не более 2 электронов,
на второй – не более 8,
на третьей – не более 18,
на четвертой – не более 32.
Валентный слой — это внешний электронный слой. На нём находятся валентные электроны, которые участвуют во взаимодействии с другими атомами. Известно, что на внешнем энергетическом уровне может находиться не бол е е восьми электронов, его называют завершенным. Восьми-электронный внешний слой характеризуется повышенной устойчивостью (это — «правило октета»).
Электронные слои, не содержащие максимального числа электронов, называют незавершенными.
Число электронов на внешнем уровне электронной оболочки атома равно номеру группы для химических элементов главных подгрупп (обозначены в таблице А-группа).
Пример: +15P – V группа (А) – на внешнем уровне 5 электронов
Для элементов побочных подгрупп (В) число электронов на внешнем уровне = двум.
Исключения (один электрон) – хром, медь, серебро, золото и некоторые другие.
Схемы строения оболочек атомов
кремния: углерода:


Электронные орбитали могут иметь разную форму и энергию: сферическую (s), гантелеобразную (p) и более сложные конфигурации (d) и (f).
Сферическую атомную орбиталь называют s-орбиталью. В ней находятся s-электроны. Она самая устойчивая и располагается довольно близко к ядру.

S – орбиталь
На каждом уровне может находится одна S – орбиталь, в которой может разместится два разных s-электрона (s2) – они отличаются своим вращением – один по часовой стрелке, а другой против.
Гантелеобразная p-орбиталь:

Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x, y и z.

Всего на каждом уровне может быть три p – орбитали:

Так как в каждой из таких орбиталей может разместиться по два р-электрона, то всего на каждом уровне p-электронов может быть 6 (p6).
d - орбиталь – это две гантелеобразные p-орбитали, соединенные центрами – как объёмная четырехлепестковая ромашка, их на подуровне может быть 5.

В каждой может разместится по два d-электрона, итого всего d–электронов на одном уровне может быть максимально 10 (d10).
f – орбиталь - имеет более сложную форму, три перекрещивающихся гантели - как объёмная шестилепестковая ромашка - их может быть на одном подуровне 7.

В каждой может разместится по два f-электрона, итого всего f–электронов на одном уровне может быть максимально 14 (f14).

Каждая орбиталь имеет собственную энергию отличную от других, поэтому энергетические уровни расщепляются (расслаиваются) на подуровни:
- на 1 уровне – s- подуровень,
- на 2 уровне – s- и p- подуровни,
- на 3 уровне – s-, p- и d- подуровни,
- на 4 уровне – s-, p-, d- и f- подуровни.
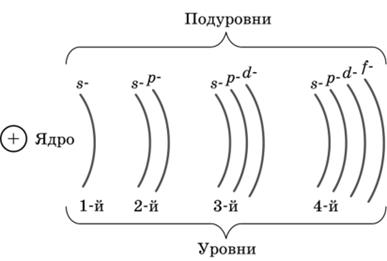
Чем дальше от ядра находится энергетический уровень и подуровень, тем больше его энергия. А электроны стремятся к минимальной энергии (принцип наименьшей энергии), поэтому заполнение электронами начинается с самого ближнего к ядру (внутреннего) уровня.
 2020-05-25
2020-05-25 549
549







