Химия 9 класс
Г.
Тема: Насыщенные и ненасыщенные углеводороды.
Алканы (предельные или насыщенные углеводороды, парафины) – углеводороды, атомы углерода в которых соединены простыми связями. Общая формула: CnH2n+2.
Соотношение числа атомов водорода и углерода в молекулах алканов максимально по сравнению с молекулами углеводородов других классов.
Поскольку все валентности углерода заняты либо углеродами, либо водородами, как правило, химические свойства алканов не очень ярко выражены, поэтому их еще называют предельными или насыщенными углеводородами. И существует еще более древнее название, лучше отражающее их относительную, конечно, химическую инертность – парафины, что переводится как «лишенные сродства».
Пространственное строение молекул
Атомы углерода в алканах находятся в состоянии sp3 - гибридизации, и молекулу алканов
можно представить как набор тетраэдрических структур углерода, связанных между собой и с водородом. Рис. 1.
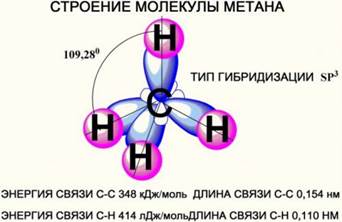
Рис. 1. Тетраэдрическое строение метана
s-связи между атомами Н и С прочные, практически неполярные (очень мало полярные).
Атомы вокруг простых связей постоянно вращаются. Поэтому молекулы алканов могут принимать разные формы. При этом длина связи и угол между связями остаются постоянными. Формы, переходящие друг в друга за счет вращения молекулы вокруг σ-связей, называют конформациями молекулы. Рис. 2.
| 
| 
|
Рис. 2. Конформация молекулы
Номенклатура предельных углеводородов
Первые четыре члена ряда алканов имеют исторически сложившиеся названия. Рис. 3.
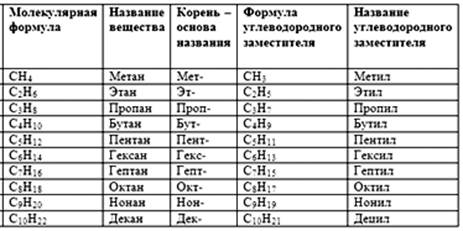
Рис. 3. Названия неразветвленных алканов
Названия неразветвленных алканов с пятью и более атомами углерода в молекуле образованы от греческих числительных, отражающих это число атомов углерода.
Суффикс -ан показывает принадлежность вещества к насыщенным соединениям.
Составляя названия разветвленных алканов по номенклатуре ИЮПАК, в качестве основной цепи выбирают цепь, содержащую максимальное число атомов углерода. Основную цепь нумеруют таким образом, чтобы заместители получили наименьшие номера. Если цепей одинаковой длины несколько, то главной выбирают цепь, содержащую наибольшее число заместителей. См.рис. 4–6.
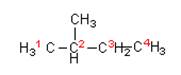
Рис. 4. 2-метилбутан
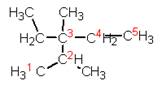
Рис. 5. 2,3-диметил-3-этилпентан
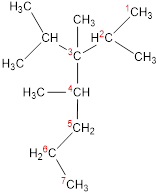
Рис. 6. 2,3,4-триметил-3-изопропилгептан
Физические свойства
Температуры плавления и кипения в целом увеличиваются с увеличением числа атомов С в молекуле. Первые представители ряда алканов – газы при н.у., алканы, содержащие от 5 до 15 атомов С – обычно жидкости, свыше 15 атомов С – твердые вещества.
Неразветвленные изомеры имеют более высокую температуру кипения, чем разветвленные (причина – разные силы межмолекулярного взаимодействия). Температуры плавления зависят, кроме того, от плотности упаковки молекул в кристалле. Табл. 1.
Табл. 1. Физические свойства алканов.
| Название вещества | Молеку-лярная формула | Структурная формула | Температура плавления, °С |
| Метан | СН4 | СН4 | –182 |
| Этан | С2Н6 | СН3-СН3 | –183 |
| Пропан | С3Н8 | СН3-СН2-СН3 | –188 |
| Бутан | С4Н10 | СН3-(СН2)2-СН3 | –138 |
| Изобутан (2-метилпропан) | С4Н10 | (СН3)2СН-СН3 | –160 |
| Пентан | С5Н12 | СН3-(СН2)3-СН3 | –130 |
| Изопентан (2-метилбутан) | С5Н12 | (СН3)2СН-СН2-СН3 | –160 |
| Неопентан (2,2-диметилпропан) | С5Н12 | СН3
СН3 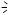 С-СН3
СН3 С-СН3
СН3
| –17 |
| Гексан | С6Н14 | СН3-(СН2)4-СН3 | –95 |
| Гептан | С7Н16 | СН3-(СН2)5-СН3 | –91 |
| Октан | С8Н18 | СН3-(СН2)6-СН3 | –57 |
| Нонан | С9Н20 | СН3-(СН2)7-СН3 | –51 |
| Декан | С10Н22 | СН3-(СН2)8-СН3 | –30 |
| Гексадекан | С16Н34 | СН3-(СН2)14-СН3 | 18 |
| Эйкозан | С20Н42 | СН3-(СН2)18-СН3 | 36,7 |
Газообразные и твердые алканы не пахнут, жидкие алканы обладают характерным «бензиновым» запахом.
Все алканы бесцветны, легче воды и нерастворимы в ней. Алканы хорошо растворяются в органических растворителях, жидкие алканы (пентан, гексан) сами широко используются как растворители.
При обычных условиях алканы не взаимодействуют с кислородом воздуха. Для начала реакции нужно либо открытое пламя, либо хотя бы электрическая искра. Если подвести первоначальную энергию, реакция будет продолжаться самопроизвольно, поскольку она экзотермическая, т.е. в процессе реакции выделяется много энергии.
Рассмотрим эту реакцию на примере горения метана. В смеси газообразных алканов с воздухом обычно взрывоопасны, в довольно широком диапазоне концентрации.
CH4+2O2→CO2+2H2O+Q
Термический крекинг
При нагревании до температуры выше 500оС в молекулах алканов происходит разрыв связей между атомами С, и образуются углеводороды с меньшей молярной массой – алканы и алкены. Нагревание производят без доступа воздуха. Чем выше температура крекинга, тем более легкие углеводороды образуются.
Наиболее энергетически выгоден разрыв молекулы пополам, но связи рвутся и в других местах:
С10Н22¾®C5Н12+С5Н10;
С10Н22¾®C4Н10+С6Н12;
С10Н22¾®C6Н14+С4Н8 и т.д.
 2020-05-25
2020-05-25 652
652







