1 Металлы взаимодействуют с простыми веществами:
Ca + Cl2 = CaCl2.
2 Активные металлы реагируют с водой:
2Na + 2H2O = 2NaOH + H2↑.
3 Активные металлы взаимодействуют с водородом:
Т
Са + Н2 = СаН2.
гидрид
кальция
4 Металлы, стоящие до водорода, взаимодействуют с разбавленными растворами кислот:
Zn + 2HCl = ZnCl2 + H2↑.
5 Металлы реагируют с водными растворами солей менее активных металлов:
Ni + CuSO4 = NiSO4 + Cu.
6 Металлы реагируют с кислотами-окислителями:
Cu + 2H2SO4 (конц) = CuSO4 + SO2↑ + 2H2O,
Т
Zn + 2H2SO4 (конц) = ZnSO4 + SO2↑ + 2H2O,
Zn + HNO3 (разб.) = Zn(NO3)2 + NH4OH.
7 Щелочные металлы взаимодействуют со спиртами и фенолами:
2R─ОН + 2Nа = 2R─ONa + H2.
спирт алкоголят
натрия
2С6Н5ОН + 2К = 2С6Н5ОК + Н2.
фенол фенолят калия
8 Металлы взаимодействуют с кислородом с образованием основных или амфотерных оксидов, пероксидов, надпероксидов, двойных оксидов:
2Mg + O2 = 2MgO,
4Al + 3O2 = 2Al2O3,
2Na + O2 = Na2O2,
K + O2 = KO2,
3Fe + 2O2 = Fe3O4.
9 Некоторые металлы, которые соответствуют амфотерным гидроксидам, взаимодействуют с растворами щелочей:
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2,
2Al + 2KOH + 10H2O = 2K[Al(OH)4∙(H2O2)] + 3H2.
Получение металлов
В промышленности металлы получают пиро-, гидро- и электрометаллургией.
Пирометаллургия – получение металлов из руд с помощью реакций восстановления, проводимых при высоких температурах. В качестве восстановителей применяют уголь, оксид углерода (II), водород, метан.
Т
Cu2O + C = 2Cu + CO,
Т
WO3 + 3H2 = W + 3H2O.
Гидрометаллургия – получение металлов из растворов их солей. Например, при обработке раствором серной кислоты медной руды, содержащей оксид меди (II), медь переходит в раствор в виде сульфата:
CuO + H2SO4 = CuSO4 + H2O.
Затем медь извлекают из раствора электролизом или с помощью порошка железа:
CuSO4 + Fe = FeSO4 + Cu.
Электрометаллургия – получение металлов с помощью электролиза растворов или расплавов солей:
электролиз
2NaCl → 2Na + Cl2.
Коррозия (от лат. «corrosio»- разъедание) - это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае - это разрушение любого материала, будь то металл или керамика, дерево или полимер. Причиной коррозии служит термодинамическая неустойчивость конструкционных материалов к воздействию веществ, находящихся в контактирующей с ними среде. Пример - кислородная коррозия железа в воде:
4Fe + 6Н2О + ЗО2 = 4Fe(OH)3.
Гидратированный оксид железа Fe(OН)3 и является тем, что называют ржавчиной.
В повседневной жизни для сплавов железа (сталей) чаще используют термин «ржавление». Менее известны случаи коррозии полимеров. Применительно к ним существует понятие «старение», аналогичное термину «коррозия» для металлов. Например, старение резины из-за взаимодействия с кислородом воздуха или разрушение некоторых пластиков под воздействием атмосферных осадков, а также биологическая коррозия. Скорость коррозии, как и всякой химической реакции, очень сильно зависит от температуры. Повышение температуры на 1000С может увеличить скорость коррозии на несколько порядков.
По типу агрессивных сред, в которых протекает процесс разрушения, коррозия может быть следующих видов: газовая коррозия; атмосферная коррозия; коррозия в неэлектролитах; коррозия в электролитах; подземная коррозия; биокоррозия; коррозия под воздействием блуждающих токов.
По условиям протекания коррозионного процесса различаются следующие виды: контактная коррозия; щелевая коррозия; коррозия при неполном погружении; коррозия при полном погружении; коррозия при переменном погружении; коррозия при трении; межкристаллитная коррозия; коррозия под напряжением.
По характеру разрушения: сплошная коррозия, охватывающая всю поверхность: равномерная; неравномерная; избирательная; локальная (местная) коррозия, охватывающая отдельные участки пятнами; язвенная; точечная (или питтинг); сквозная; межкристаллитная (расслаивающая, в деформированных заготовках, и ножевая, в сварных соединениях).
Главная классификация производится по механизму протекания процесса. Различают два вида: химическую коррозию и электрохимическую коррозию.
Химическая коррозия - взаимодействие поверхности металла с (коррозионно-активной) средой, не сопровождающееся возникновением электрохимических процессов на границе фаз. При таком взаимодействии окисление металла и восстановление окислительного компонента коррозионной среды протекают в одном акте. Например, образование окалины при взаимодействии материалов на основе железа при высокой температуре с кислородом:
4Fe + 3O2 → 2Fe2O3
При электрохимической коррозии ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала металла (например, ржавление стали в морской воде).
Разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов называют электрохимической коррозией (рисунок 2). Не следует путать с электрохимической коррозией коррозию однородного материала, например, ржавление железа или т.п. При электрохимической коррозии (наиболее частая форма коррозии) всегда требуется наличие электролита (конденсат, дождевая вода и т. д.), с которым соприкасаются электроды - либо различные элементы структуры материала, либо два различных соприкасающихся материала с различающимися окислительно-восстановительными потенциалами. Если в воде растворены ионы солей, кислот или т.п., электропроводность ее повышается и скорость процесса увеличивается.
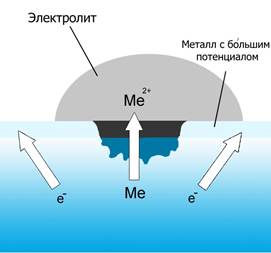
Рисунок 2 - Коррозионный элемент
При соприкосновении двух металлов с различными окислительно-восстановительными потенциалами и погружении их в раствор электролита, например, дождевой воды с растворенным углекислым газом CO2, образуется гальванический элемент, так называемый коррозионный элемент. Он представляет собой не что иное, как замкнутую гальваническую ячейку. В ней происходит медленное растворение металлического материала с более низким окислительно-восстановительным потенциалом; второй электрод в паре, как правило, не корродирует. Этот вид коррозии особо присущ металлам с высокими отрицательными потенциалами. Так, совсем небольшого количества примеси на поверхности металла с большим редокс-потенциалом уже достаточно для возникновения коррозионного элемента. Особо подвержены риску места соприкосновения металлов с различными потенциалами, например, сварочные швы или заклёпки.
Если растворяющийся электрод коррозионностоек, процесс коррозии замедляется. На этом основана, например, защита железных изделий от коррозии путём лужения или оцинковки - олово или цинк имеют более отрицательный потенциал, чем железо, поэтому в такой паре железо восстанавливается, а олово или цинк должны корродировать. Однако в связи с образованием на поверхности олова или цинка оксидной плёнки процесс коррозии сильно замедляется.
 2020-05-25
2020-05-25 106
106








