Вычислим молярную теплоёмкость идеального газа при различных изопроцессах в соответствии с её определением:
С=  .
.
1. Изотермический процесс:
 ∞.
∞.
Здесь всё сообщённое газу тепло Q идёт на совершение работы:
dQ = pdV + ν CV dT | T= const = pdV = dA.
2. Изохорный процесс:
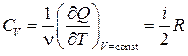 .
.
Здесь тепло идёт только на нагрев газа: dQ = ν CV dT = dU.
3. Изобарный процесс:
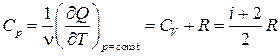 .
.
Здесь тепло идёт и на нагрев, и на совершение газом работы: dQ = dU + pdV.
4. Адиабатный процесс:
 .
.
Работа идеального газа при изопроцессах
 Вычислим работу идеального газа при различных изопроцессах в соответствии с её определением
Вычислим работу идеального газа при различных изопроцессах в соответствии с её определением
А =  . (4.5)
. (4.5)
1. Изотермический процесс.
Подставив в (4.5) выражение р из уравнения pV = ν RT 0, получаем (рис. 4.6):
 .
.
2. Изохорный процесс. Так как здесь V = const, то А = 0.
3. Изобарный процесс. Так как здесь р = const = р 0, то (рис. 4.7)

 .
.
4. Адиабатный процесс.
Так как здесь Q = 0. то работа газа совершается только за счёт его внутренней энергии:
А = Q − Δ U = −Δ U = −ν CV Δ T = ν CV (Т 1 − Т 2). (4.6)
Отсюда видно, что при адиабатном расширении, когда А = p Δ V > 0, газ охлаждается, т. е. Δ Т < 0.
Если в формулу (4.6) подставить Т 2 из уравнения адиабаты T 1 V 1γ−1= T 2 V 2γ−1, то получим ещё одно выражение для работы газа при адиабатном процессе:
А = ν СV Т 1(1 − (V 1/ V 2)γ−1).
 2020-05-21
2020-05-21 67
67







